https://www.cphi.cn 2018-04-16 10:54 来源:CPhI制药在线 作者:南郭先生
作为肿瘤免疫治疗的开路先锋,PD-1/PD-L1单抗自上市之日起就备受市场追捧,成为国际制药巨头的必争之地。2014年默沙东的Keytruda、BMS的Opdivo在先后被FDA批准上市,2016年第一个PD-L1单抗--Tecentriq(罗氏)上市,2017年辉瑞与默沙东的Bavencio、阿斯利康的Imfinzi相继上市。短短四年时间,先后五款同类药物上市。每个药物背后都站着一个实力雄厚的制药巨头,每个公司又都把这个药物视为未来几年立足肿瘤免疫治疗领域的重磅产品。
PD-1/PD-L1单抗也没有辜负大众的追捧,Opdivo(BMS)和Keytruda(默沙东)自2014年上市后销售额便一路飞涨,在2017年分别在交出了48.48和38.09亿美元的成绩单,即使在2016年5月份刚刚上市的Tecentriq也交出了4.87亿瑞士法郎的满意答卷。
为了在这激烈的竞争中占得优势,各个公司也是开足火力,其中BMS先后进行了40项临床研究,默沙东和罗氏分别以32和26项临床研究紧随其后。
1、蜂拥而上的玩家
已经在欧美市场得到了高度认可的靶点,自然成为国内生物公司的首选目标。于是我们就看到了这样一张表单(图1):31家企业参与PD-1/PD-L1领域的竞争,4家已经提交上市申请(包含一家撤回申请)、18家正在进行临床、9家申报临床后等待批准、当然还有很对尚未提交临床申请的公司。如果未来按照BMS、默沙东或者罗氏开展临床数量的一半估算,临床中出现着病人不够用、临床专家不够用的境地也就不是笑谈。此刻那些还未申报的甚至还在排队等临床的玩家,正面临壮士断腕退出竞争还是直面惨淡的人生继续进行的抉择。
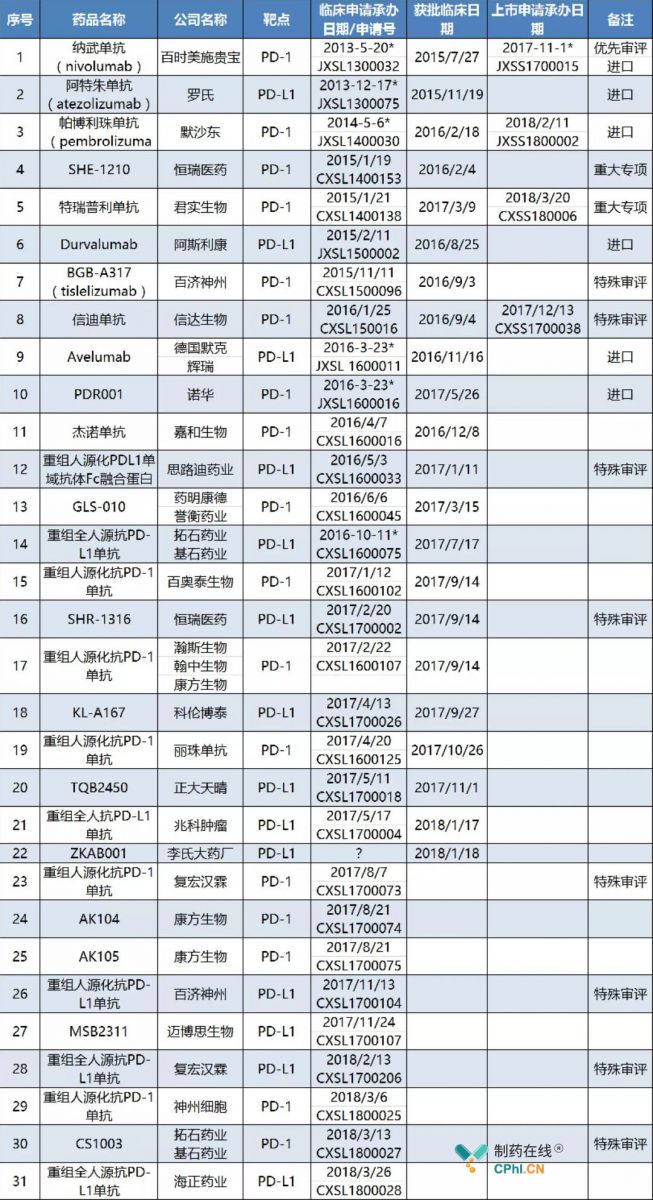
图1:已在国内提交临床试验申请的PD-1/PD -L1单抗(按临床申请承办日期先后排列)来源:CFDA,CDE网站,公开新闻,医药云端工作室
2、产品是否具备独有的优势?
产品是否真正具备独有的优势也是考量产品是否进一步向前推动的标准。目前在研产品,大多数的"创新点"在于:新的抗体序列(除了能申请专利之外,似乎看不到对产品质量上的提升)、对Fc区域进行"优化"(上市产品中也有Fc优化产品)、纳米抗体、提高亲和力、在肿瘤局部微环境起效等等。其实这些能在临床上起到多少颠覆性优势,估计自己都会心知肚明!
药物上临床之后,发生怎么样的不良反应也很难预测。即使是国内医药企业一哥的恒瑞,自家的PD-1单抗产品估计目前也面临艰难的抉择。在去年的ASCO(美国临床肿瘤学会)上,一篇《Phase I study of the antiPD-1 antibody SHR-1210 in patients with advanced solid tumors》文章公布58名患者不良反应情况,有79.3%的受试者出现反应性毛细血管瘤症状。尽管没有看到其他不良反应的详细报告,但是Opdivo(BMS)和Keytruda(默沙东)出现的各种不良反应,应该也会出现。因此即使勉强上市,在未来市场竞争中,靠什么去说服医生和病人放心使用自己的药物?
3、未来国家宏观政策可能带来的影响
面对一个靶点一窝蜂的申报现状,政府在《药品审评审批信息公开管理办法(征求意见稿)》中已经说明"公开同一品种申报企业数量3家以上的药品名单,引导申请人有序研发和理性申报"。我们大胆揣测一下,这句话暗含的意思就是:前面申报太多时,后面的就不要来烦我了,来了我也引导你退出。
李克强总理在最新召开的国务院常务会议上进一步落实在两会上提出的"进口癌症药物零关税",决定自今年5月1日起兑现这一承诺。需要引起警惕的是,国内已提交上市申请的产品中就包括了Keytruda和Opdivo,引狼入室的局面已经形成。
放远目光来看:中美贸易战中关于知识产权的争论也是重中之重,为保护国内企业,目前国内关于抗体药物专利保护和欧美还有一定差距。最显著的就是,国内目前还不会对抗体/抗原作用位点进行专利保护。在美国安进和赛诺菲在PCSK9上关于作用位点的专利争端、BMS控告默沙东Keytruda用于治疗转移性黑色素瘤侵犯专利的案件,未来也许会在国内上演。作为后来者难免会面对身前对手的重重专利壁垒。
小结:一般认为,同一靶点前三家上市产品几乎可以完全占领整个市场,第四、第五家若有雄厚财力和销售渠道可以不亏钱或微赚,其余的都是稳亏不转的酱油党。因此即使几百亿市场,又与你何干!还未申报临床甚至排在图1中进度后二十位的玩家,可以提前思考一下自己的产品有多大的创新性优势可颠覆前面产品;自己产品的安全性、有效性有没有做过扎实的基础研究;自己又有多少资本作为后盾面临未来临床和市场的竞争;还有政策上调控和知识产权上面的收紧等未知因素。面对可能会颗粒无收的坚守,放手PD-1/PD-L1单抗,另选新欢或许才是更好的选择。面对已经到来的肿瘤免疫治疗时代,怕被时代抛弃,这或许是更多参与者不忍放手的原因。但是风起时,一定不是一片树叶在招手。
作者简介:南郭先生,博士研究生,立足免疫学领域,多年从事**及抗体药物的研究;曾参与微针**经皮给药系统研究、治疗型乙肝**的基础研究等。现坚持生物医药领域的研究工作,专注于抗体药物,对免疫治疗和双特异性抗体领域有深入研究。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030