https://www.cphi.cn 2019-12-10 10:49 来源:CPhI制药在线 作者:zhulikou431

药典是药品研发、注册、生产和质量管理的关键技术标准,是药品科学技术发展成果的结晶,是一个国家药品产业发展水平的标志,是药品生产经营者的基本遵循,是药品监管工作的准绳。药典在推动药品质量提升以及在药品注册审批过程中起着积极而极其重要的作用,同时药典也兼具科学性、先进性、规范性和权威性,是保障药品疗效与安全的有力武器。随着2020年的临近,中国药典也即将迎来每五年一次的更新颁布。
目前现行的中国药典为2015版(第十版);历次沿革包括1953年版(第一版)、1963年版(第二版)、1977年版(第三版)、1985年版(第四版)、1990年版(第五版)、1995年版(第六版)、2000年版(第七版)、2005年版(第八版)、2010年版(第九版)。半个多世纪以来,中国药典收载品种由最初的531种增至目前的5608种,内容也随着"科学、实用、规范"的编纂原则以及密切跟踪国际制药通用性技术文件要求的发展趋势等要求日趋完善,中国药典从第二版开始分为一二两部,2005年增设生物制品为三部,2015版将药用辅料单独成卷作为《中国药典》四部。1988年10月,第一部英文版《中国药典》1985年版正式出版。另外,药典委员会还在中国药典编纂基础上完成了《红外光谱集》、《中药材显微鉴别彩色图鉴》、《中药材薄层色谱彩色图集》、《中国药品通用名称》、《国家药品标准工作手册》,《中国药典注释》、《临床用药须知》等多种配套丛书多版的编写和出版。
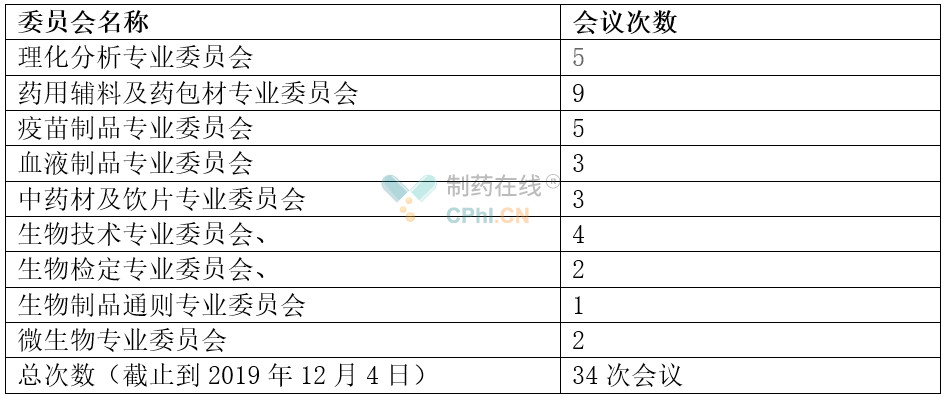
为了完成2020年版中国药典的编制及其他国家药品标准的制定和修订工作,2017年8月成立了第十一届药典委员会。据不完全统计,2019年药典委员会分别组织药用辅料及药包材专业委员会、**制品专业委员会、生物制品通则专业委员会、生物技术专业委员会、生物检定专业委员会、微生物专业委员会、理化分析专业委员会、中药材及饮片专业委员会、血液制品专业委员会等召开了多次会议(详见表1)。
表1 药典委员会各相关委员会会议情况统计表
中药和化药部分通则修订进展
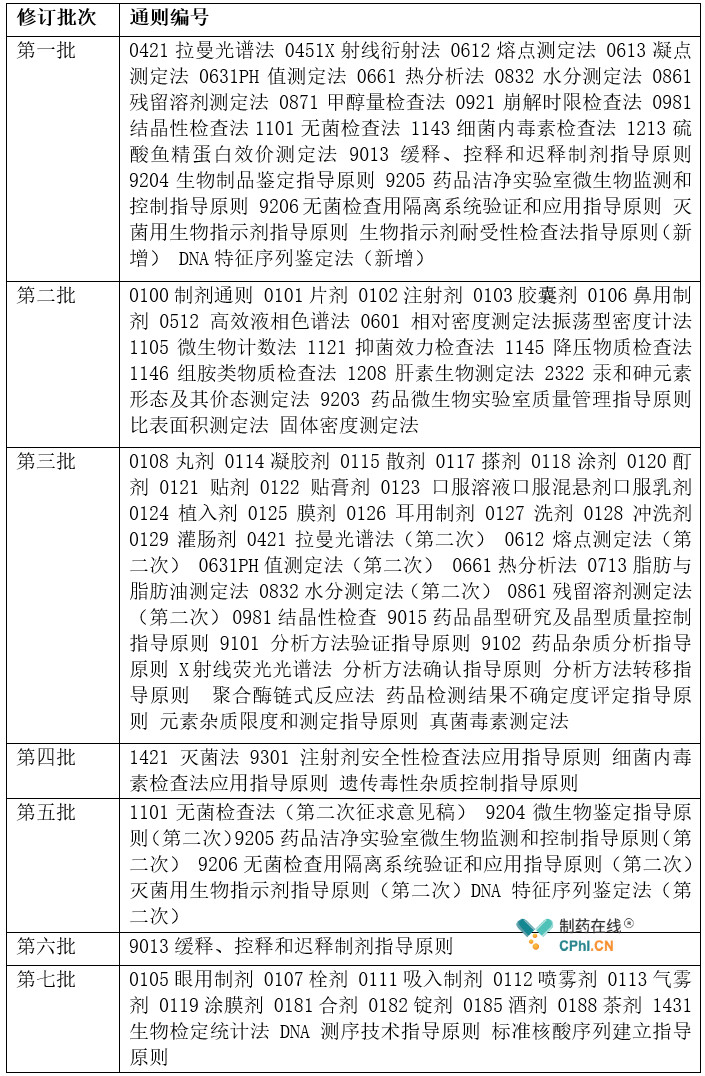
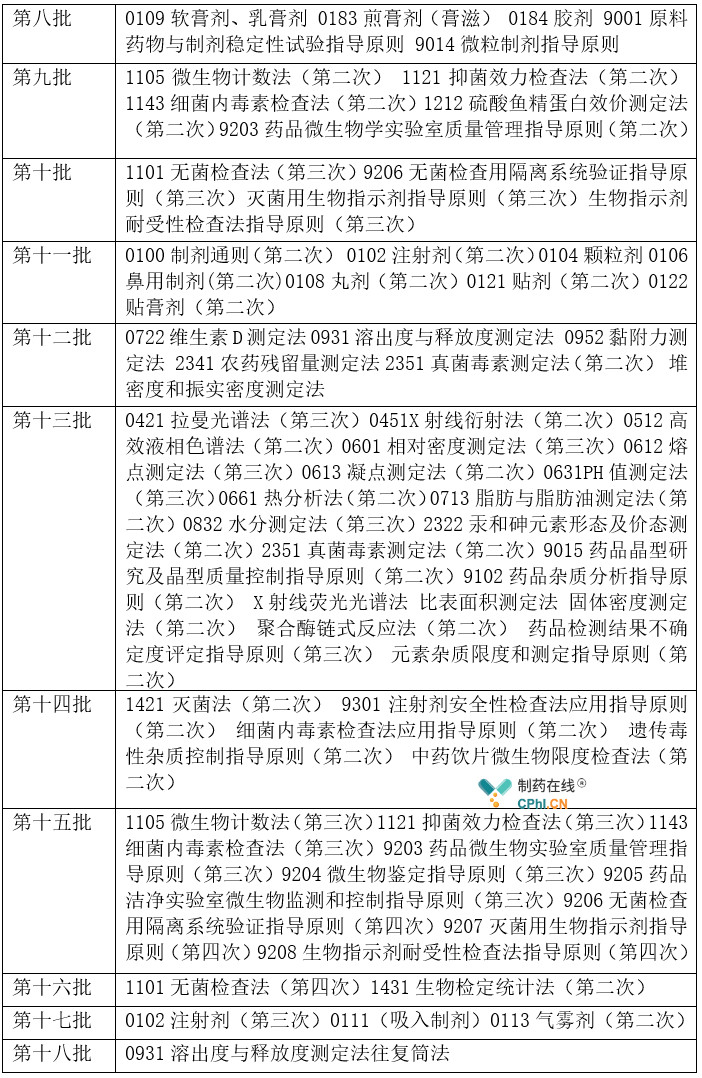
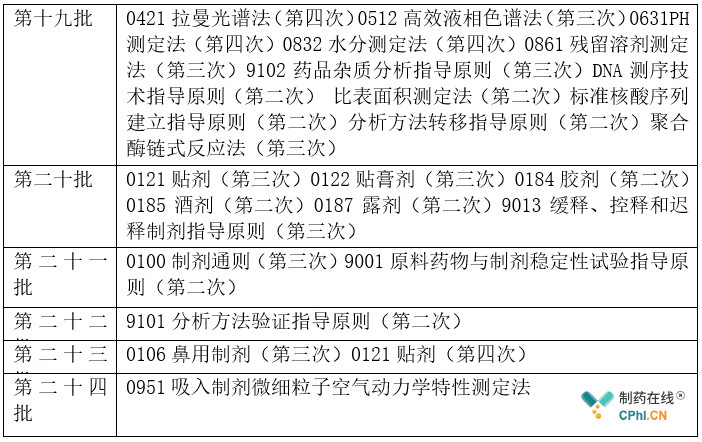
中药和化学药品作为中国药典固有部分,不仅在药典中占有较大比例,也在药品生产和质控环节居于统治地位。下表汇总了涉及中药和化学相关的通则和指导原则的修订情况(详见表2)。
表2 中药和化学通则修订情况统计
中药部分热点分析
1.中药饮片开始要求测试微生物限度:在2020版药典《中药饮片微生物限度检查法》中明确规定,这个通则适用于药材和饮片。而且规定检查过程需要注意无菌操作,需要单向流工作区域;这些要求都需要中药饮片企业进行硬件改造。但是制药行业业内对此通则反对意见很大,认为药材和饮片来自自然界和后续粗加工,生长环境和加工环境都是一般区域,而且大部分药材在进入人体之前,都需要进行后续降低微生物负荷量的各类灭菌或者高温工序,进行微生物控制实在无必要。
2.农药残留量测定法:在中国药典通则《2341农药残留量测定法》中,对如下内容进行了修订:有机氯类农药残留量限度进行了修订;增加了第四法农药多残留量测定法-质谱法。从草案看,如果这个通则最后实施,将对中药企业产生很大成本压力,不管是仪器购买,还是标准物质购买,还是实施过程中耗费的精力,都是相当大的。
3.真菌毒素测定法:中国药典通则原来的《黄曲霉毒素测定法》在2020版药典上面修订为《2351真菌毒素测定法》。此通则适用于药材、饮片和中药制剂。增加了榆玉米赤霉烯酮测定法、呕吐毒素测定法、展青霉素测定法、多种真菌毒素测定法。
化学部分热点分析
1.微生物实验室管理规范修订:这个指导原则主要增加了MDD(微生物数据偏差)概念,此概念以后会在微生物实验室逐步代替OOS概念。MDD调查特点是充分考虑微生物数据偏离的复杂原因,不仅仅调查实验室,还需要扩展到车间,并对污染菌进行菌种鉴别。
2.稳定性试验指导原则进行修订:2015版中国药典最大弊端就是稳定性试验指导原则和2010版药典保持一致,没有任何修改。此次2020版药典虽然进行了修订,但是制药行业从业人员大多认为,药典不应该再制定关于稳定性试验指导原则了,应该采用ICH Q1指南和2015年国家药监局发布的稳定性试验指导原则。
3.分析方法转移指导原则:这是2020版药典新增的技术指导原则。
4. 药品洁净实验室微生物监测和控制指导原则:这次修订,对于悬浮粒子取样点数量、微生物监控标准、警戒限和行动限设定都进行了挑战。但是必须提出,国内对于无菌微生物监控的认识和国际制药行业差距很大;如果某企业要通过欧美认证,完全采用中国药典技术要求,存在较大合规风险。
5.内毒素检测方法修订:这个指导原则最大变化是增加重组因子C的新方法。这种方法已经在EP10和USP42被收载,属于国外比较成熟的方法。此方法不再使用鲎试剂,具有检测快、方法简单、重现性好的特点。
6.增加基因**指导原则:2020版药典新增《遗传**杂质控制指导原则》,对遗传**(也称基因**)杂质进行控制。此指导原则主要受浙江华海缬沙坦事件影响,主要参考ICH M7来撰写。
生物制品通则修订进展
生物制品自2005年版纳入药典后,不断得到发展和完善。随着近几年国内生物制品企业研发和注册快速发展,生物制品在患者救治领域和医药投资领域热点颇多。因此,这版药典也适时扩大了修订程度和范围(参见表3)。
表3 生物制品通则修订情况统计
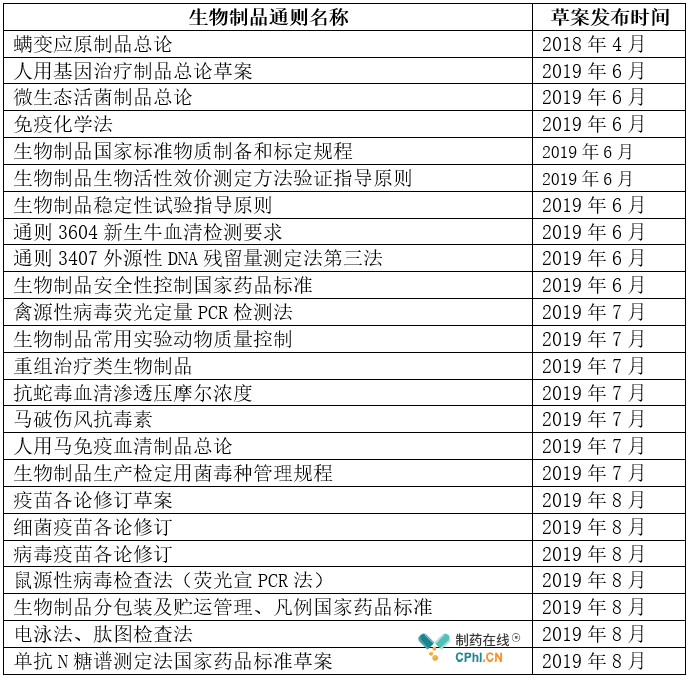
生物制品部分热点分析
1. 原液合批问题:在2020版药典草案《人用重组DNA蛋白制品总论修订》上面提到,如果企业经过检验,确认单批原液合格,经过评估,可以和其他批次合格的原液进行合并。截图如下:

2. 稳定性试验指导原则:应该说在中国大陆地区,自1949年到2015年,就没有专门针对生物制品的稳定性试验指导原则。在2015年,国家局根据ICH Q5指南起草了生物制品稳定性试验指导原则。尽管本次2020版药典也起草了这份指导原则,制药从业人员建议还是依据2015年国家局颁布的生物制品稳定性试验指导原则,避免冲突和歧义。
辅料和包材通则修订进展
随着原辅包关联审评政策推进,以及国内一致性评价工作的持续推行,药品辅料和包材对药品研发、注册和质控影响日益增加。为了更好的管理辅料和包材,为企业实施原辅包关联审评提供技术支撑,这版药典不仅扩大修订了辅料相关通则,还增加了很多涉及包材管理的通则(参见表4)。
表4 辅料和包材通则修订情况统计
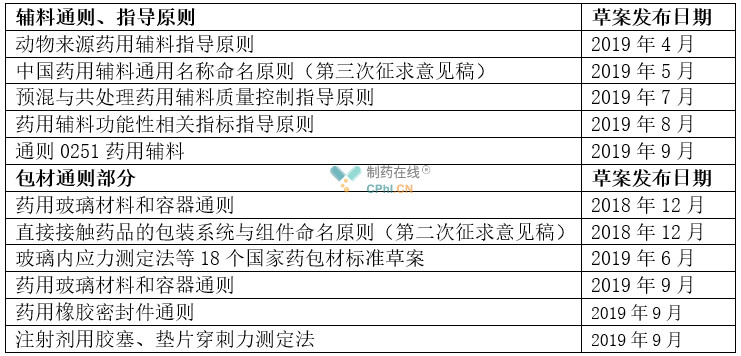
辅料部分热点分析
1. 辅料命名更规范:2020版药典发布了《中国药用辅料通用名称命名原则》草案,这是针对辅料行业对产品命名很不规范而发布的,可以有效规范命名,厘清行业争议。
2. 辅料功能性指标设定更规范:对于处于原辅包关联审评环境内的辅料企业,在登记自己的辅料标准时,经常处于两难境地。如果登记辅料项目很多,以后生产和销售就会被限制只能生产符合登记标准的辅料;而实际情况是,辅料企业面对的客户是多源的,有些客户有特殊指标需求,有些客户没有。因此这个指导原则可以更好的协助辅料用户来判断自己登记标准的科学性。
包材部分热点分析
应该说,包材技术指导原则纳入药典是中国药典历史上第一次这样做,也是中国药典向国际药典学习和不断进步的表现。这次修订加入的一些指导原则,多是参考欧美药典翻译和调整后的,对于中国企业更全面认识药品研发和注册阶段质量属性确定和保持,非常有帮助。
综述
综上所见,2020版药典到目前为止,在2019年已经基本成型。不管是具体品种,还是各类药品的指导原则,都在不断完善和修订中。毫无疑问,将在2020年末颁布的中国药典2020版将对中国制药企业的研发、注册、质控都产生明显影响,也会对正在申报的研发项目产生很大影响;而且对于企业实验室预算也会产生明显影响,预计2020年5月份以后,很多分析仪器价格将上涨。
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030