https://www.cphi.cn 2020-04-03 12:40 来源:CPhI制药在线 作者:zhulikou431
美国FDA在愚人节发布了《FDA Updates and Press Announcements on NDMA in Zantac (ranitidine)》,不仅解释了雷尼替丁产品中基因**杂质的变化特点,而且要求所有雷尼替丁制造商从市场上撤回该产品。尽管这篇重要的药品安全文件是在愚人节(2020年4月1日)发布的,但是各国制药界并不将其视为笑话,而是重大监管信号。
FDA在上面警示文件中提到雷尼替丁产品中基因**杂质变化特点如下:
※-在正常贮存条件下,雷尼替丁中 NDMA 含量也会增加;
※较高温度(包括产品在分销和由消费者处置的过程中产品可能暴露的温度)下贮存的样品 NDMA 显著增加;
※雷尼替丁产品越老,或者自生产出厂以来的时间越长,NDMA 的含量就越高。
上面提到的这些信息,显示雷尼替丁产品中基因**杂质不是稳定存在的,而是随着流通时间和外界条件在持续增加,这会对患者产生不可接受的风险,因此说,最后被退市也是官方所必须采取的措施之一。
雷尼替丁是临床常用药,主要用于治疗消化性溃疡、反流性食管炎、卓-艾综合征、上消化道出血,缓解胃酸过多所致的胃痛、胃灼热感(烧心)、反酸。如果要替换雷尼替丁,估计会对很多患者产生较大影响。
基因**杂质被中国制药界和中国患者所关注,不是自雷尼替丁开始,而是始于2018年中期的浙江华海缬沙坦事件。笔者根据自己掌握信息,为各位梳理一下国内相关法规变化和市场变局的可能走向。
第一部分:国内针对基因**杂质所采取的合规工作
在2018年中期,浙江华海发现并主动向欧美药政当局上报了所生产缬沙坦原料药中基因**杂质的情况。此事将ICH M7涉及的基因**杂质风险推到前台,被欧美法规当局高度重视。在2018年第四季度,美国FDA和欧盟药政当局先后检查浙江华海,并发出警告信。不仅如此,欧盟EDQM还发布了针对基因**杂质NDMA和NDEA的分析方法,以及过渡期间的控制限度。随着浙江华海持续努力,终于在2019年第四季度成功通过欧盟再次检查,接触警告,货物可以继续出口欧盟市场。在2020年3月,浙江华海顺利完成国内的补充申请,缬沙坦原料药和制剂可以恢复在中国市场的销售。
下表列出了国内药监部门采取的合规工作:
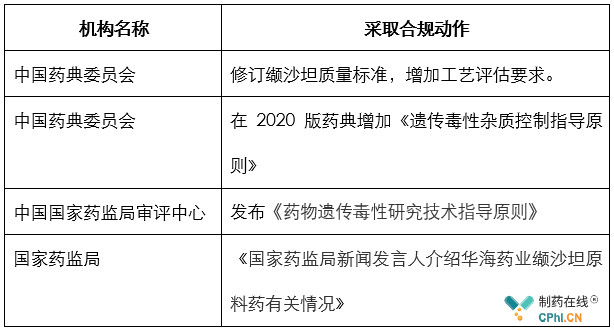
在本次雷尼替丁基因**杂质事件发生后,到目前为止,在中国国家药监局官网没有查询到类似管控文件。但是在河南省药监局和甘肃药监局官网查询到类似管控文件。甘肃省局发布了《甘肃省药品监督管理局关于通报开展雷尼替丁、尼扎替丁中N-亚硝基二胺杂质风险控制有关情况的函》,而河南省局发布《关于对雷尼替丁、二甲双胍产品开展专项检查的通知》,先后从市场招标和生产环节进行控制,避免风险扩大。
第二部分:国内雷尼替丁产品的市场布局分析
根据NMPA数据库和丁香园insight数据库,目前在国内已经登记的雷尼替丁原料药情况如下:
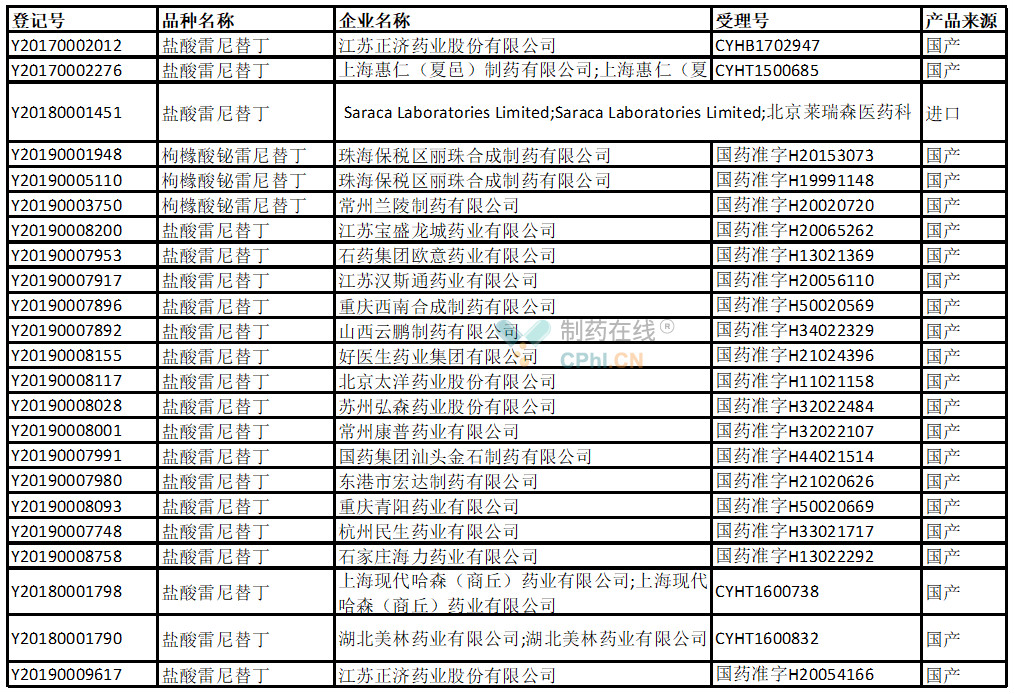
截止到2020年4月初,在国家局cde数据完成原辅包登记的雷尼替丁原料药企业共23家,其中大部分属于国内企业,进口原料药只有一家。
根据NMPA数据库和丁香园insight数据库,到目前为止,国内生产各类雷尼替丁的制剂企业很多,共持有有效批文共577个。根据数据库核实,到目前为止通过一致性评价的企业是石药集团欧意制药和山东瑞阳制药。
扫描下方二维码发送“雷尼替丁”,可下载国内生产雷尼替丁相关制剂企业名单。

第三部分:国内药政部门可能采取的合规措施预测
虽然美国FDA要求雷尼替丁生产企业采取措施逐步退市,但是考虑到此产品是临床常用药,估计国内药政部门不会立即跟进。根据笔者的工作经验,预测中国国家药监局会采取如下合规工作:
※对类似产品启动专项检查,提高生产和销售环节合规水平。
※组织专家拟定杂质安全限度,要求所有生产雷尼替丁企业符合过渡期安全限度。不符合限度的产品不得销售。
※同时,要求生产企业尽快提出变更,如果可以通过工艺变更回避基因**杂质的影响,完成变更后,可以继续销售。
不过无论如何,随着欧盟和FDA对雷尼替丁对类似产品的持续监管,中国药监局不会一直保持放任的态度;而随之带来的市场变局,估计会给所有涉及企业带来压力。
说明:本文不构成价值判断和投资建议。
参考文献
1- FDA官网信息
2- FDA《FDA Updates and Press Announcements on NDMA in Zantac (ranitidine)》
3- EDQM官网信息
4- NMPA官网信息
5- 河南省药监局官网信息
6- 甘肃省药监局官网信息
7- 丁香园insight数据库
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。
点击下图进行CPhI & P-MEC China 2020观众预登记抽奖,奖品多多!
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030