https://www.cphi.cn 2020-07-01 10:25 来源:CPhI制药在线 作者:菜菜
6月29日,Intercept公司宣布奥贝胆酸治疗非酒精性脂肪性肝炎(NASH)引起的肝 脏纤维化的上市申请被FDA拒绝(完全回应函CRL)。受此消息影响,Intercept股价盘前暴跌38%,市值蒸发10亿美元从25亿美元跌至15亿美元。
对于此次拒绝的理由,FDA认为中期组织学终点数据带来的获益仍具有不确定性,并建议Intercept提供正在进行的REGENERATE后续有效性和安全性数据,以评估是否达到获益风险比。

(资料来源:Intercept官网)
奥贝胆酸治疗NASH的临床研究REGENERATE最初计划采用复合终点:肝纤维化程度至少改善1级且NASH没有恶化的患者比例,肝 脏蓄积脂肪被清除且纤维化程度没有恶化的患者比例。后来改为只需达到其中一个终点即可。
2019年10月,柳叶刀杂志发表了REGENERATE的中期数据,治疗18个月的纤维化改善(≥1级)且NASH没有恶化的终点达到。
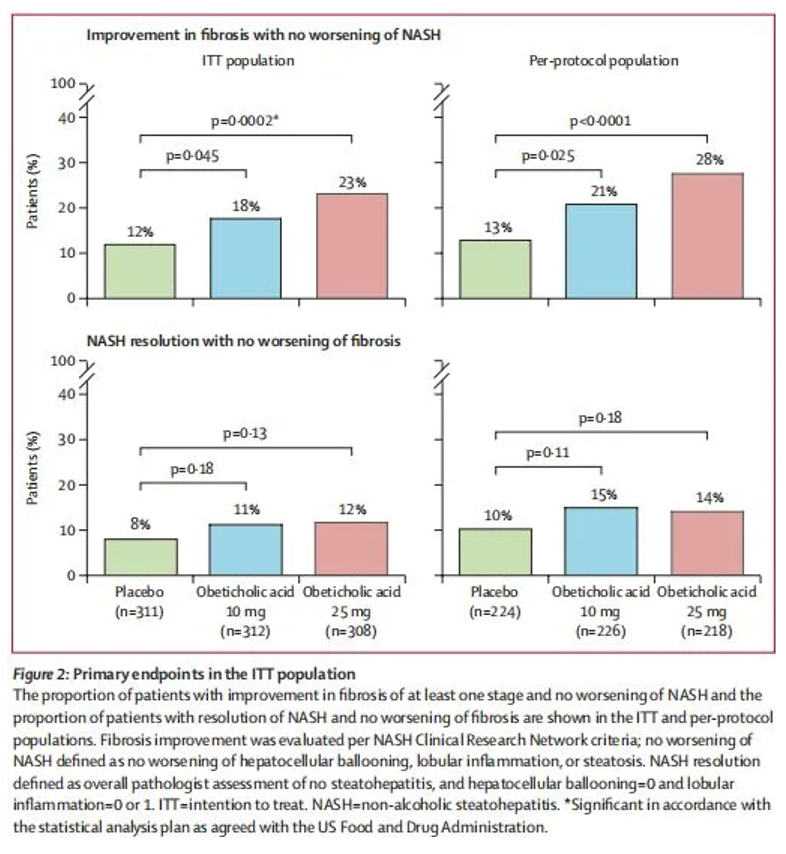
(资料来源:The Lancet)
奥贝胆酸(Obeticholic acid,商品名:Ocaliva)由Intercept研发,是一种法尼酯X受体特异性激动剂。2016年5月美国FDA有条件加速批准其用于治疗原发性胆汁性胆管炎,是近20年来首 个获批治疗原发性胆汁性胆管炎的药物。PDB数据库显示,在全球市场上自2016年奥贝胆酸上市以来其市场规模不断扩增,2019年销售额2.5亿美元。
此次奥贝胆酸延缓上市,会影响国内哪些药企?
♦ 一方面,国内正在开发奥贝胆酸仿制药的药企受到影响,正大天晴首当其冲。
根据"药物临床试验登记与信息公示平台"数据,正大天晴、复旦张江、恒瑞等均开展了奥贝胆酸的临床研究。
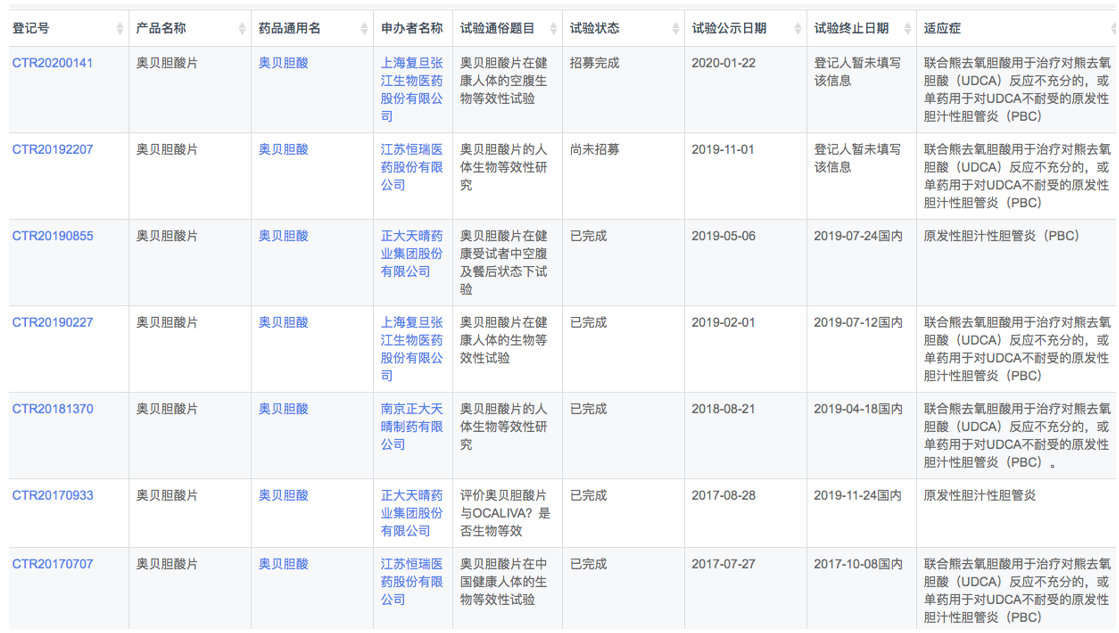
(资料来源:药物临床试验登记与信息公示平台)
其中,正大天晴进展最快,2019年6月就已提交3类仿制药用于NASH上市申请,2020年5月提交用于治疗原发性胆汁性胆管炎(PBC)的上市申请。
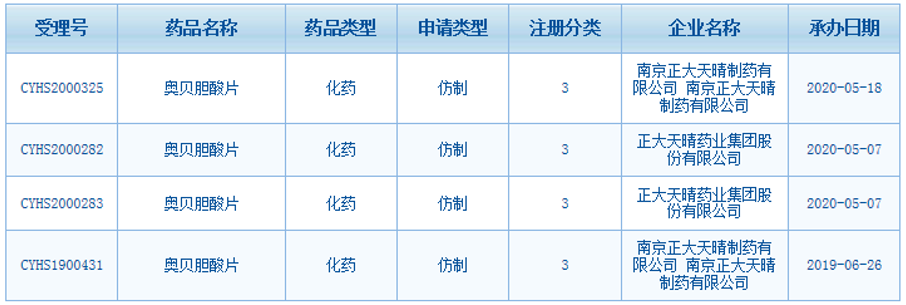
(资料来源:CDE)
此次,奥贝胆酸被拒,笔者认为正大天晴3类仿制药的上市进度也会受到影响,NMPA会更加谨慎地审评相关临床数据。
♦ 另一方面,国内外NASH研发热度或许会稍微降温。
目前,国外已有一个NASH药物上市,就是印度的Saro glitazar。
2020年3月,印度药企的Saro glitazar获得印度药品管理局批准,Saro glitazar成为全球首 个获批用于治疗NASH的药物,正式拉开NASH江湖大幕。Saro glitazar为PPARα/γ双重激动剂,于2013年9月在印度上市,用于他汀类药物无法控制的血脂异常/高甘油三酯血症的II型糖尿病患者治疗;2020年1月,该药适应症获批扩大至II型糖尿病患者治疗。
除此之外,进度最快的就是Intercept的奥贝胆酸了。Intercept于2019年9月向FDA提交了奥贝胆酸治疗NASH适应症的新药申请,并被授予优先审评资格,在2020年1月,Intercept发布公告称FDA推迟了PDUFA的日期,由原定的3月26日延后到6月26日,推迟了整整3个月。
国外进入Ⅲ期临床的NASH/NAFLD药物
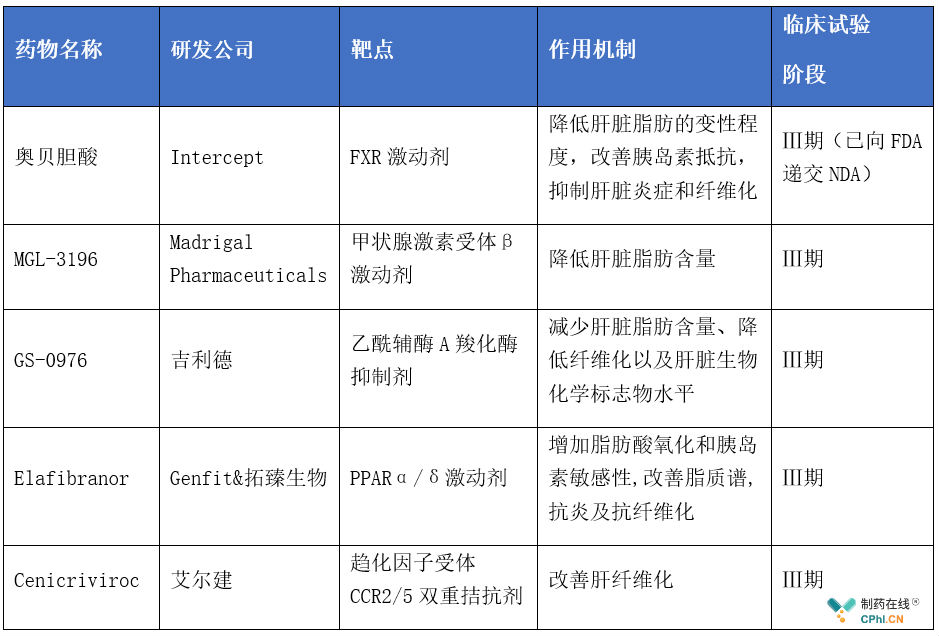
(根据公开资料整理,如有不全处,欢迎补充)
国内众多药企也在积极布局NASH领域,其中候选药物多采取与国外公司合作的方式。
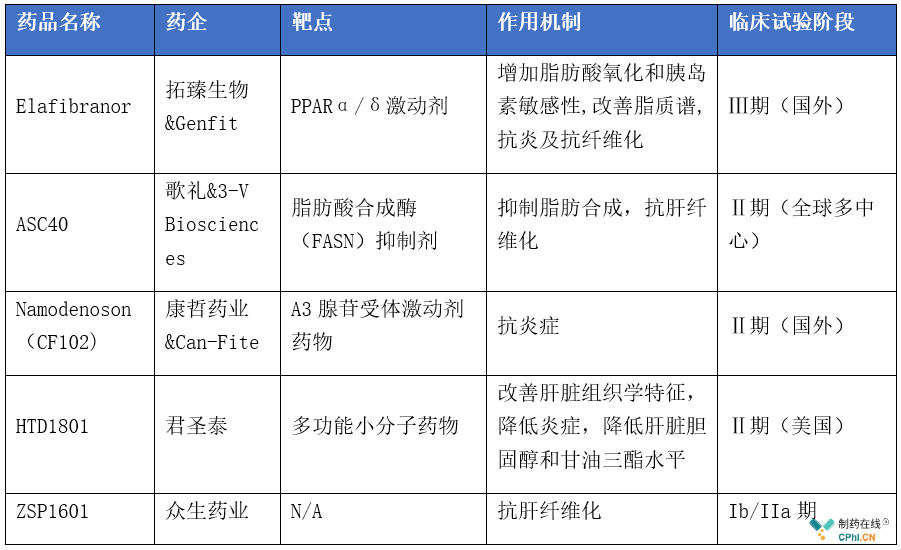
2019年2月,歌礼制药与3-VBiosciences就TVB-2640达成战略合作与大中华区独家开发协议,TVB-2640(歌礼代号:ASC40)是一种脂肪酸合成酶抑制剂,是治疗NASH的候选药物,目前处于临床Ⅱ期。
2019年6月,拓臻生物与Genfit签订协议,拓臻生物出资2.28亿美元的前期付款及里程碑付款,获得了Elafibranor在NASH和PBC等适应症的大中华区独家开发、注册和商业化权益,目前处于临床Ⅲ期阶段。
2020年6月,ASC40的Ⅱ期临床数据显示其显著降低了肝 脏脂肪含量(此试验的主要疗效终点),50mg组别中,肝 脏脂肪降低30%以上的患者比例为61%vs对照组11.1%。该指标的横向参考比较:吉利德的Firsocostat为47.8%vs对照组15.4%,诺华的Tropiflexor为64%vs对照组20%,Madrigal的Resmetirom为74.4%vs29.4%。ASC40的研发在国内处于第一梯队,若能顺利上市,则具有先发优势。
国内NASH/NAFLD药物研究进展
(根据公开资料整理,如有不全处,欢迎补充)
除此之外,正大天晴、东阳光等药企也均有布局,但均处于临床Ⅰ期。
400亿美元NASH江湖
非酒精性脂肪性肝病(NAFLD)包括单纯性脂肪肝、非酒精脂肪性肝炎(NASH)及NASH相关肝硬化,其中,NASH是指在肝细胞脂肪变性基础上发生的肝细胞炎症,是NAFLD中较严重的一种类型。如不治疗,单纯性脂肪肝可能发展为NASH,而后者进展为肝硬化。NASH患者数量庞大,全球患病人数大约占全球总人口的2-3%,中国发病率略低于西方。
据EvaluatePharma预测,到2025年,全球NASH药物市场规模将达到400亿美元,如此庞大的市场,NASH江湖急需重磅炸 弹的来临。
作者简介:菜菜,上海交通大学药学硕士,曾工作于科学技术情报研究所,现为药监系统从业人员,擅长解读行业法规、药研动态等。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030