https://www.cphi.cn 2020-12-21 14:48 来源:CPhI制药在线 作者:zhulikou431
2020年对于地球居民肯定是魔幻的一年;年初爆发的新冠肺炎疫情持续发酵,在欧美有席卷之势。中国境内虽然通过政府和民众共同努力,对于新冠疫情控制取得较好成绩;但是由于新冠的广泛影响,很多行业受到影响。
中国制药行业通过多年发展,不仅仅为中国境内抗击新冠疫情提供了强力支持,也为世界各国抗击新冠疫情做出了突出贡献。然而,由于2020年是中国法规体系重新构建和完善之年份,因此,中国制药同仁在2020年度需要面对繁重的法规和技术要求学习任务。
在中国重新构建的法规体系中,新引入的年报制度是一个参考欧美监管做法而实施的新事物。2020年11月11日实施的**MAH年报和2020年12月发布的药品MAH年报草案,为制药企业同仁指明了工作方向和技术要求。
然而,笔者通过对上述两份文件学习,发现国家药监局发布的上述文件还存在较多抵牾之处,会成为制药企业具体申报年报人员的疑虑和焦灼的问题,需要进行充分讨论;也提醒药政当局在对药品MAH年报定稿发布时,对相关问题进行阐释和厘清。
焦灼点1-**MAH应该提交几份年报
很多战友看到这个问题,估计会觉得多余,认为一个**MAH就应该提交一份年报。因为在2020年11月11日,国家药监局发布的《关于发布**上市许可持有人质量年度报告撰写要求(试行)的通告》(后面简称**年报通告)提到:原则上一个持有人撰写一份质量年度报告,持有人有多品种规格时,产品质量部分有关内容应当按规格分别撰写,如同一品种有多个规格,产品质量部分应当分别撰写。
但是,在2020年12月8日,国家药监局发布的《国家药监局综合司公开征求《药品年度报告管理规定》(征求意见稿)和《药品年度报告模板》(征求意见稿)意见》(后面简称药品年报草案文件)中,对于药品年报的要求是:每个品种填写一份品种报告信息,该品种有多个制剂规格的(药品批准文号/注册证号),只填写一份品种报告。从这段话看,药品年报是针对品种的,MAH需要为每个品种都单独递交一份年报。
不仅如此,在国家局这份草案文件后面提供的模板里面,还出现了**生产企业或者MAH字样。
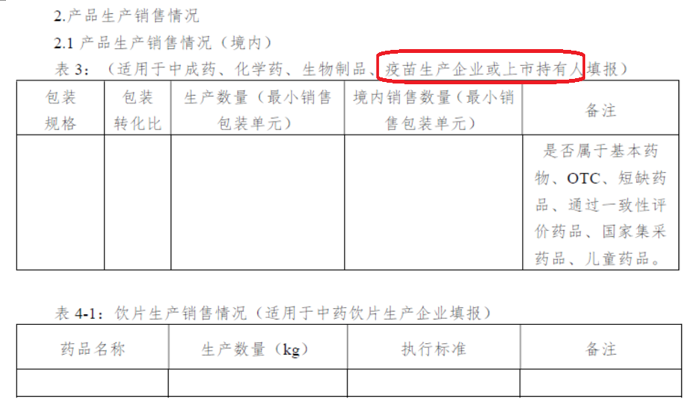
这样的要求就更让制药行业困惑了。如果按照目前最新文件,一个**MAH如果持有8个品种,就需要递交1+8=9份年报。其中,1份年报是为了符合**MAH年报要求,其余8份是针对具体**品种的年报。制药人的这个焦灼,需要官方尽快行为明确。
焦灼点2-年报采用的语言要求是什么?
按理说,这个问题不应该成为问题。在前面提到的**年报通告中,已经明确要求采用中文。但是,在2020年12月发布的药品年报草案文件中,对于此问题却没有提及。而且,中国市场上还有很多进口药品;这些进口药品MAH所提交年报采用的语言,也需要明确作出要求。制药人的这个焦灼,需要官方尽快行为明确。
焦灼点3-年报涵盖产品范围需要明确
从前面提到的**年报通告和药品年报草案文件看,要求企业提交数据的覆盖时间范围是每年1月1日到12月31日。但是对于一个企业,就需要面对一个问题:如果一批产品在2020年12月28日投料生产,但是生产完毕日期是2021年1月4日,那么这批产品属于2020年度数据统计范围内吗?
这个问题和官方无关,需要各制药企业结合GMP和自己的内部规定来明晰规定。根据2010版中国GMP,一个制剂产品的生产日期确定原则是:
◆ 除另有法定要求外,生产日期不得迟于产品成型或灌装(封)前经最后混合的操作开始日期,不得以产品包装日期作为生产日期。
◆ 原料药混合批次的有效期应当根据参与混合的最早批次产品的生产日期确定。
◆ 回收处理后的产品应当按照回收处理中最早批次产品的生产日期确定有效期。
从上面这些中国GMP技术规定看,制剂产品和某些特殊情况已经有法规依据了。但是对于中药饮片、提取物、中药制剂、生物制品和原料药等产品,制药企业还需要结合具体情况,在内部规定清晰,避免统计数据混乱和冲突。制药人的这个焦灼,需要制药企业自己解决。
焦灼点4-哪些变更需要在年报中提交
对于这个问题,估计很多制药同仁也会认为不是问题。因为官方很多法规已经明确规定,在过去一个年度中,MAH所发生的所有变更(重大变更+中等变更+微小变更)都需要申报。问题是,在一个规范的MAH中,一般变更按照性质会分为三类:
◆ 药品注册类变更
◆ 生产监管了变更
◆ 质量体系类变更
上述三类变更还会发生内容的交叉和相互影响。因此说,一份年报是提交MAH在过去一个年度所有的变更,还是只提交药品注册类变更和生产监管类变更,是需要在官方涉及年报的发文中给与明确的。制药人的这个焦灼,需要官方尽快行为明确。
焦灼点5-企业多年前已经执行但是未申报的重大变更要申报吗?
应该说,这个问题是中国药品MAH的负责人和质量负责人将在2021年春天面对的最焦灼的问题。因为这个问题不仅仅是技术问题,而是合法与否的问题。
在此,本人建议中国国家药监局尽快将《药品上市后变更管理办法(试行)(征求意见稿)》定稿。因为这份文件中有关键一条:
第二十三条【新旧制度衔接】 新修订《药品管理法》和《药品注册管理办法》实施前,持有人或生产企业按照原生产工艺变更管理的有关规定和技术要求经研究、验证证明不影响药品质量的变更,或经过批准、再注册的工艺变更,不需按照新的变更管理规定及技术要求重新申报,不因新的变更管理规定及技术要求的变化视为非法。再次发生变更的,应按现行变更管理规定和技术要求执行,并纳入品种档案。
最后这条焦灼点的解决,需要国家药监局勇于承担历史责任,敢于做出有利于中国制药行业的关键决策;让全行业释放历史包袱,然后规范前行。
莫畏浮云遮望眼,勇士当膺改革锋。在2020年冬季写下上面文字的时候,我们真的期望2021年中国制药行业的药政体系构建和改革工作在正确道路上走的快一些。
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030