https://www.cphi.cn 2021-01-07 14:39 来源:CPhI制药在线 作者:zhulikou431
GMP的中文名称是药品生产质量管理规范,1962年在美国诞生的GMP规范和配套制度是世界各国药监系统对制药企业实施监管和评估的权威系统。目前,在大部分规范医药市场上,如果药品要想获得市场通行证,必须通过所在市场监管当局的GMP检查。
到目前为止,中国制药行业先后经历四个版本的GMP规范,分别是1988版GMP、1992版GMP、1998版GMP和2010版GMP。在2015年末之前,中国药监系统实施的GMP认证分为2级认证,即国家药监局负责高风险药品的GMP,这些产品涵盖无菌制剂、血液制品和生物制品等;而各省局负责较低风险的药品GMP认证,包括口服原料药、无菌原料药、眼用制剂和口服制剂等。在2015年末,随着药政体系改革,所有GMP认证业务都移交给各省局,国家局主要负责各类核查、重大案件的飞行检查和境外企业检查。
第一部分:GMP认证终结和目前国家法规要求
随着2019年12月1日,新修订《药品管理法》的实施,实施多年的中国GMP认证被取消了,取而代之的是GMP符合性检查。下表介绍了目前中国最新国家级法规的规定和要求:


分析:从上面最新国家级法规内容可以看出,虽然从形式上看,新的法规体系取消了GMP认证,但是在法规要求和现实操作中,药品企业必须规范运行;如果药品要想上市销售,必须经过GMP动态检查。
第二部分:后GMP认证时代,各省局的规定情况
由于自2015年末开始,实施GMP认证和检查是各省局的责任;因此,在新的法规体系取消GMP认证后,各省局都根据国家局文件**,通过内部讨论,发布了适合本省情况的GMP符合性检查要求。下表列出了各省发布的配套文件情况:
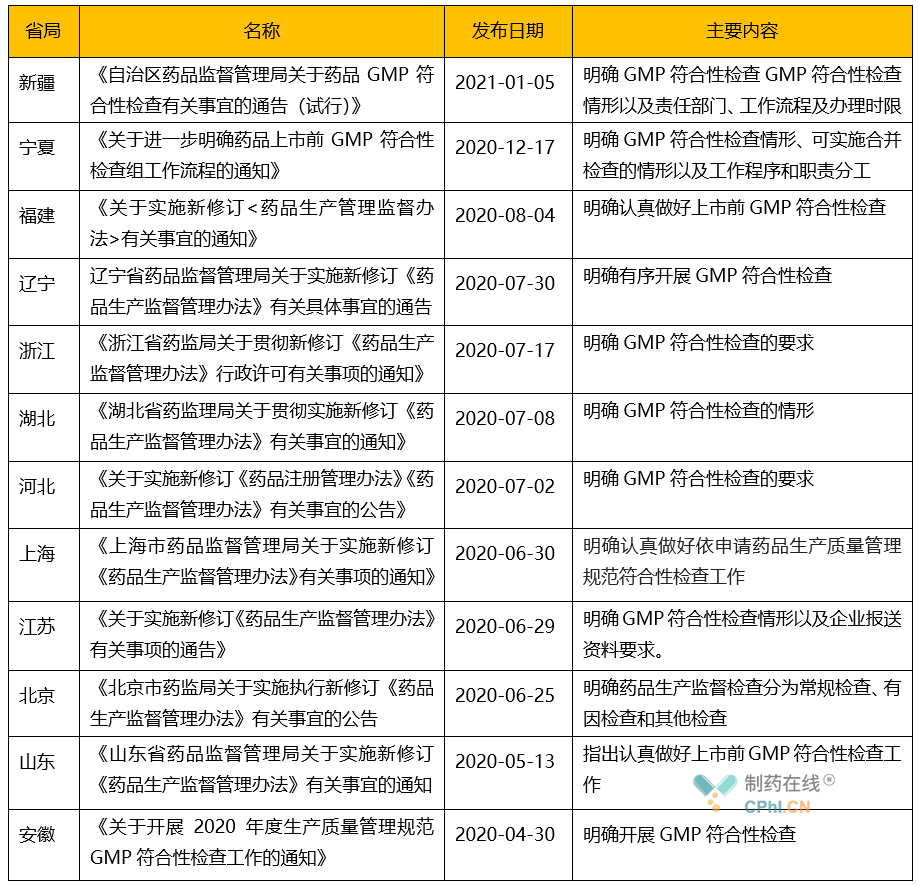
经过检索,在2021年元旦之后,也就是2021年1月5 日,新疆维吾尔自治区药品监督管理局发布了《自治区药品监督管理局关于药品GMP符合性检查有关事宜的通告(试行)》,这是目前省级药监局发布的最新一份相关文件。其中,通告中列举了国家药品监督管理局对药品GMP符合性检查的规定以及负责该工作的责任部门、工作流程及办理时限。
分析:通过对上面各省局文件进行汇总和分析,目前各省局发布的文件,主要体现了如下特点:
第一.各省局法规文件一般明确药品GMP符合性检查会包括以下几种情形:(一)上市前的药品GMP符合性检查。(二)原址或者异地新建、改建、扩建车间或者生产线的药品GMP符合性检查。(三)委托生产的药品GMP符合性检查。(四)未进行药品GMP符合性检查的。(五)高风险药品生产企业的药品GMP符合性检查。
第二.GMP符合性检查会基于风险评估来进行,而不是固定检查频率。正如前面所提到的,凡是属于如下企业,一般被检查概率较高:无菌制药企业、生物制品企业、**企业、血液制品企业、刚获得产品上市批准的创新药企业、中药注射剂企业、过去内部举报较多企业、上一年度市场抽检不合格批次较多企业等。
第三.每次GMP符合性检查不一定是全面检查,会根据现实情况而选择局部检查或者针对重点品种的检查。这种GMP符合性检查更多的情况是配合药品注册、一致性评价、药品抽检情况核实等情形来开展。
第四.允许技术实力较弱省份借用外省技术资源。例如,目前上海、浙江、江苏和安徽形成长三角联盟,允许在各类GMP符合性检查和核查中,相互借用其他省份技术专家来完成检查任务。自然,西北省份也会出现借用其他省份的检查专家的情况。
第五.有些省份在逐步开展借用社会力量的符合性检查。例如山东省多年前已经开展购买社会资源服务的情况,从咨询公司聘请专家开展各类检查。再例如目前吉林省局从制药企业招募兼职检查人员,都是不断尝试之路。
总之,随着各省局不断发布配套法规和技术指导原则基础上,对于药品的检查和监管体系肯定会更完善。这一切也提醒制药企业,必须把遵纪合规作为以后运营的基本要务来抓。
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030