https://www.cphi.cn 2021-01-14 12:07 来源:CPhI制药在线 作者:zhulikou431

2021年1月13日,国家药监局发布2021年度第8号公告,公布《药品上市后变更管理办法(试行)》。应该说,这份文件对于所有在中国市场注册药品上市的MAH,都产生了巨大影响。因此,一石激起千层浪,行业内热议纷纷。
笔者不才,深夜研读此文,认为信息量不少。为了让此重点文件可以更好的促进行业发展,笔者不揣冒昧,试为制药同仁解读一二。
第一部分:新的变更管理办法解决了哪些问题
要点1-各类变更管理职责更清晰
根据《药品上市后变更管理办法(试行)》的第四条规定:持有人是药品上市后变更管理的责任主体,应当按照药品监管法律法规和药品生产质量管理规范等有关要求建立药品上市后变更控制体系;根据国家药品监督管理局有关技术指导原则和国际人用药注册协调组织(ICH)有关技术指导原则制定实施持有人内部变更分类原则、变更事项清单、工作程序和风险管理要求,结合产品特点,经充分研究、评估和必要的验证后确定变更管理类别。
在MAH对变更进行研究和分类后,由MAH根据分类情况,分别向国家局审评中心、各省局进行补充申请或者备案;对于微小变更,有企业进行内部管理,在年末撰写年报时汇总提交。
要点2-新修订《药品管理法》生效之前已经实施的变更怎么处理
应该说,这个问题的处理既影响行业稳定发展,也对制药企业从业队伍的稳定产生持续影响。我们欣喜的看到,《药品上市后变更管理办法(试行)》第二十三条明确规定:新修订《药品管理法》和《药品注册管理办法》实施前,持有人或生产企业按照原生产工艺变更管理的有关规定和技术要求经研究、验证证明不影响药品质量的已实施的变更,或经过批准、再注册中已确认的工艺,不需按照新的变更管理规定及技术要求重新申报,再次发生变更的,应当按现行变更管理规定和技术要求执行,并纳入药品品种档案。
应该说,第二十三条的规定是本文件中最 具有人性化的条款,既释放了制药行业多年的压力,也为未来工作开拓了局面,也保持了政策的延续性。因为,2010年8月13日《关于药品再注册审查有关问题处理意见的函》(食药监注函〔2010〕168号)就明确规定"对再注册申报工艺与原批准工艺相比发生变更的,若工艺变更不影响药品质量,请生产企业报省级药品监管部门备案后,再予再注册;若工艺变更可能影响药品质量,请药品生产企业按照《药品注册管理办法》的相关规定报补充申请,待批准后再予再注册。"
要点3-原料药变更如何管理
在这份文件配套发布的《《药品上市后变更管理办法(试行)》政策解读》中,对于原料药变更给出的解决办法:已经通过审评审批的原料药发生变更的,原料药登记人应按照现行药品注册管理有关规定、药品生产质量管理规范、技术指导原则确定变更管理类别后经批准、备案后实施或报告,相关信息由登记人及时在登记平台更新。变更实施前,原料药登记人应将有关情况及时通知相关制剂持有人,便于制剂持有人开展后续工作。
未通过审评审批,且尚未进入审评程序的原料药发生变更的,原料药登记人可以通过药审中心网站登记平台随时更新相关资料。
要点4-MAH变更的申报材料给出了明确规定
首先说,MAH变更必须由国家局管理,省局无权管理。对于一个药品的MAH变更管理,这份管理办法的附件4给出了具体要求。这些资料概括来说包括四部分:药品注册证书等复印件、证明性文件、申请人承诺、其他相关资料。
要点5-变更总体分类更清晰
《药品上市后变更管理办法(试行)》第二条提到"本办法所指药品上市后变更包括注册管理事项变更和生产监管事项变更。"在后面给出了更详细解释。
但是笔者必须提醒各位制药人,在每个企业建立内部变更管理体系时,要涵盖三类变更情况。除了上面提到的注册管理事项变更和生产监管事项变更,还应该包括质量体系事项变更。最后这一类变更,有可能和前面二类变更有关系,也可能不发生关系。
第二部分:虽然政策很明确,还有疑问待解
在上面,我们介绍了国家局发布的《药品上市后变更管理办法(试行)》的要点和关键内容,应该说已经把制药行业所关心的很多问题解答了。
但是,是否真的变更大纲出,天下风尘静呢?笔者认为还不尽然。根据过去20多年的行业从业经历,结合过去一年天南海北和各地医药行业朋友沟通的情况,笔者给各位聊一聊让制药人还不放心的几件事。
疑问1-变更实施期间验证批次是否可以销售?
我们知道变更是复杂多样的。但是我们不得不承认,在大部分涉及药品质量属性的变更研究中,都需要进行工艺验证批次的生产;那么,这些工艺验证批次的产品是否可以销售呢?
在变更初期,为了支持变更研究,企业会开展实验室的小试、中试研究,也会在车间进行部分工艺放大、工艺优化、工艺摸索工作。这些研究所产生的产品由于不符合GMP,产品属性存在瑕疵,生产产品所使用的工艺和最后确定的工艺有差距,都是不能销售的。这一点企业都有清醒认识和认可。问题是,在每个变更后期,当工艺研究有结论时,根据法规和行业惯例,需要进行1-3批次的工艺验证产品的生产,以证明工艺可行并确认产品质量属性。这些工艺验证产品如果不能销售,行业损失很大,而且很浪费。
在2020版《药品生产监督管理办法》上面规定了动态批次可以销售。但是根据工作管理,这里提到的变更中的工艺验证批次多不属于动态批次;如果这些产品都不被允许销售,既不合理,也增加行业损失,导致社会财富浪费。
笔者认为这些工艺验证批次应该被销售,因为既然变更已经被批准,说明变更研究的各项工作合法合规;另外这些工艺验证批次都是上市后变更涉及的批次,这个时候发起变更的主体MAH拥有生产许可证和GMP合规状态;最后,这些工艺验证批次符合最后申报工艺,而且质量属性合格。
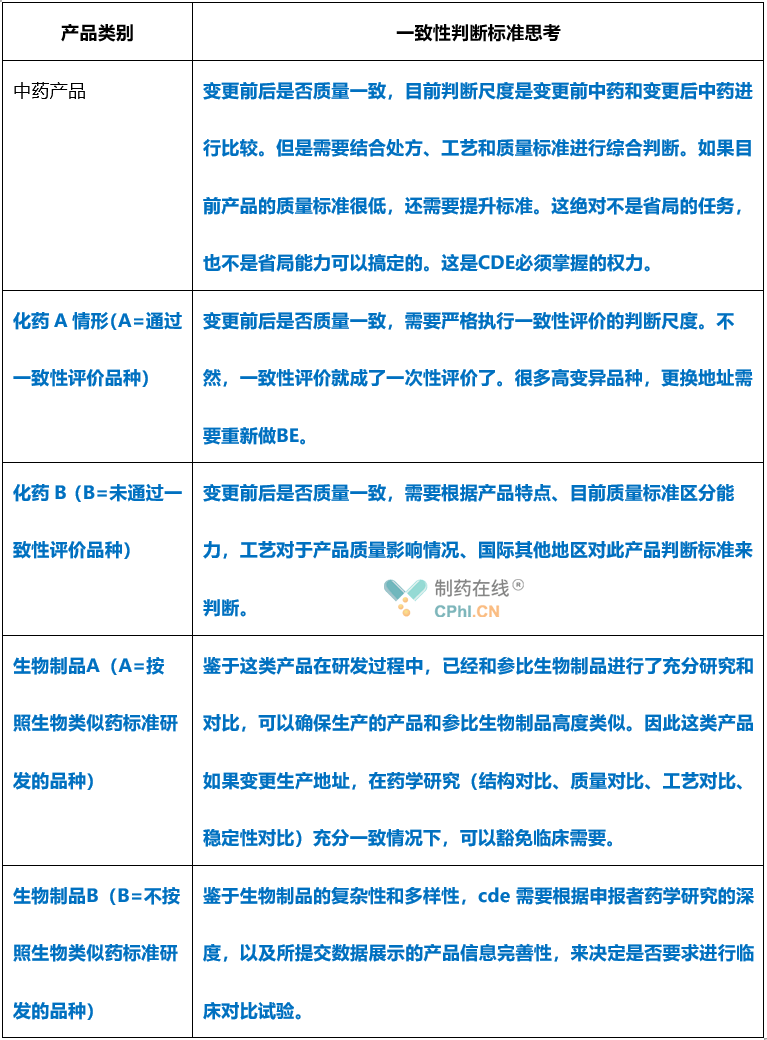
疑问2-变更前后一致性,如何理解?
《药品上市后变更管理办法(试行)》第十三条提到:变更药品生产场地的,药品的处方、生产工艺、质量标准等应当与原药品一致,持有人应当确保能够持续稳定生产出与原药品质量和疗效一致的产品。
笔者认为,这句话很重要,但是还有很多隐藏信息没有说出来。如果国家局不出台配套文件,估计以后制药行业变更存在很多争议和隐忧。
质量和疗效一致的判断标准是什么,是不是产品检测结果一致就足够?是不是重大变更都需要进行临床试验?这个问题的解决,还有待CDE进一步发文。笔者根据自己的经验,对于变更前后一致性列出如下表格:
疑问3-变更审批时间,是否可以更快一些?
对于这个问题,讲起来有很多故事;这也是导致过去国内变更管理不畅的一大原因。在某地进行技术交流时,一个制药界朋友苦笑着说:他们有一个API品种,变更某项工艺。这同一个变更在欧盟和日本药政当局方面,三年前都已经获得批准了。而在中国国家局方面,三年过去了,没有任何进展。企业无奈,只能保持2套工艺,应对不同的市场需求。
希望国内CDE和各省局提高工作效率,加快变更审批和备案速度。
疑问4-各省局真的做好应对中等变更的准备了吗?
在这份管理办法的附件3《《药品上市后变更管理办法(试行)》政策解读》中,对于备案的描述是有问题的。其中提到备案成功的标准,是这样描述的:备案不是行政许可,持有人按照备案资料要求提交资料进行备案,提交备案资料后即完成备案。
如果问题真的是这样,就存在如下疑问了:制药企业根据自己理解(而且认为已经很合理),准备了一套备案资料并提交到省局;根据上面的解释,这项备案成功完成了。
但是省局技术专家审核后,认为这些资料不全面,还需要补充其他资料。那么,这项备案是完成了呢?还是没有完成呢?
除了上面这个似是而非的问题,我们还必须要面对一个现实情况。
在2017年11月份发布的《总局关于调整药品注册受理工作的公告》(2017年第134号)的本意是提高工作效率,厘清各级药政部门职责。因为在过去很长一段时间,企业的一些合理申请由于省局不作为、乱作为和慢作为而被压制,导致企业意见很大。这份文件的出台确实让很多注册受理工作发生了很大变化,而其中不可忽视的一个变化是:很多原来由省局负责初审的事项被取消,企业可以直接到国家局递交申请。这样的安排,虽然减轻了省局的负担,但是同时也让省局技术团队的武功逐渐丧失,加之有些省局人员再主动推掉一些工作,武功丧失更快。
2019年12月1日生效的《药品管理法》掀开了中国药政体系重塑之路。在新的法规整体框架中,省局继续发挥较大作用,尤其是很多中等变更需要到省局备案。而自2017年就被逐渐废掉武功的各省局,突然应对这样的局面,从能力和心理上,都是抗拒的。
疑问5-涉及变更疑难问题,沟通渠道是否畅通?
在发布的《药品上市后变更管理办法(试行)》的第二十一条 明确规定:境内持有人在充分研究、评估和必要的验证基础上无法确定变更管理类别的,可以与省级药品监管部门进行沟通,省级药品监管部门应当在20 日内书面答复,意见一致的按规定实施;对是否属于审批类变更意见不一致的,持有人应当按照审批类变更,向药审中心提出补充申请;对属于备案类变更和报告类变更意见不一致的,持有人应当按照备案类变更,向省级药品监管部门备案。具体沟通程序由各省级药品监管部门自行制定。
如果看到上面条文,制药同仁就会认为以后关于变更的沟通很顺畅,我觉得这样的想法太天真。因为在将来很长一段时间内,不管是国家局的CDE,还是各省局审评中心,技术资源都是不足的。
中国制药行业正在从不规范到规范、仿制为主到创新比例显著增加、各类新技术应用方兴未艾的新的历史阶段。应对这样的行业发展,我认为中国国家局CDE和各省局审评机构都还存在能力建设的不足。
写罢上面文字,已是深夜时分。我也相信,对于制药企业变更的探讨,不会止于上面这些内容。希望这些浅薄的文字,可以为行业的发展提供些许帮助。
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030