https://www.cphi.cn 2021-05-11 10:51 来源:CPhI制药在线 作者:Dopine
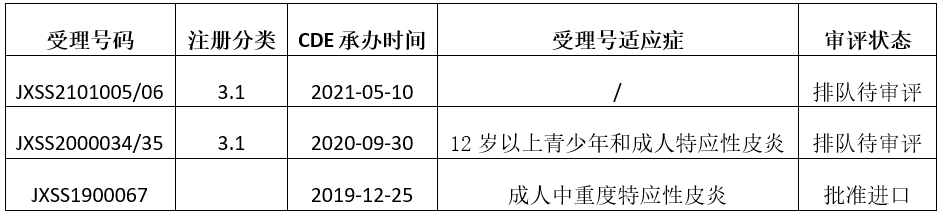
5月10日,CDE官网显示,赛诺菲度普利尤单抗注射液在国内的第三个上市申请获受理。度普利尤单抗(dupilumab,Dupixent)是再生元和赛诺菲开发的一款全人单克隆抗体,特异性抑制IL-4和IL-13的过度激活信号,2020年6月在国内首次被批准用于治疗成人特应性皮炎,商品名为达必妥。
度普利尤单抗(dupilumab,Dupixent)最早于2017年3月在美国获批,截止目前已被FDA批准多个适应症。
• 2017/03 被FDA批准用于治疗经局部治疗不能控制,或不适合使用局部治疗的特应性皮炎(AD)成人患者;
• 2018/10 被FDA批准作为一种附加维持疗法,用于治疗年龄12岁及以上、嗜酸性粒细胞表型,或口服皮质类固醇依赖性中度至重度青少年和成人哮喘患者;
• 2019/03 被FDA批准扩展适用范围,用于治疗局部处方疗法控制不佳或这些疗法在医学上不适宜的中度至重度AD青少年(12-17岁)患者;
• 2019/06 被FDA批准联合其他药物,用于治疗病情控制不足的伴鼻息肉的慢性鼻-鼻窦炎(CRSwNP)成人患者;
• 2020/05 被FDA批准作为一种附加维持疗法,用于治疗采用外用处方疗法未能充分控制疾病或当这些疗法不可取的6-11岁中度至重度AD儿童患者;
此外,FDA已经受理了Dupixent作为一种附加疗法,用于治疗年龄在6-11岁、病情不受控的中度至重度哮喘儿童患者的补充生物制品许可申请(sBLA)。而且,Dupixent用于治疗12岁及以上嗜酸性食管炎(EoE)患者的关键性3期临床试验Part A已经达到了主要终点,已被FDA授予治疗嗜酸性粒细胞性食管炎(EoE)的孤儿药资格和突破性 药物资格。
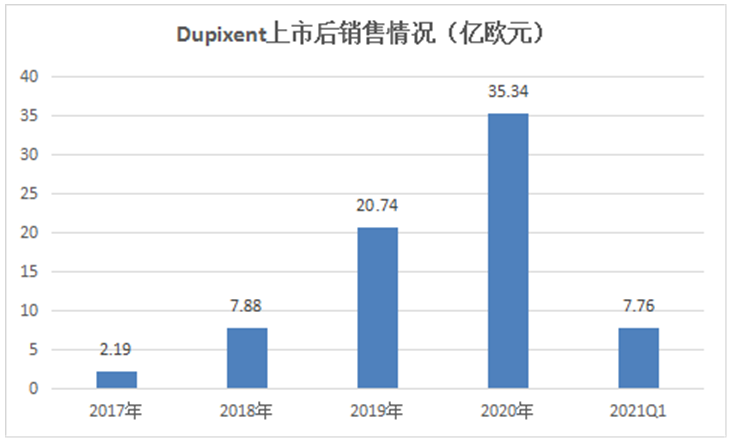
自上市后,Dupixent销售额逐年飙升,并于2020年达到40.45亿美元(35.34亿欧元)。随着适应症的增加,EvaluatePharma曾预测2024年该药的全球销售额有望达到80亿美元。
在国内,度普利尤单抗被列入2019年5月CDE发布的《第二批临床急需境外新药名单》,2019年12月在国内的首 个上市申请获CDE受理,2020年6月被NMPA批准用于治疗外用处方药控制不佳或不建议使用外用处方药的成人中重度特应性皮炎患者,商品名为达必妥。而且,达必妥顺利进入2020年国家医保,成为医保目录中唯一一个治疗中重度AD的创新药。
值得一提的是,去年我国还批准了另外一款AD药物,即辉瑞的克立硼罗软膏(crisaborole,Eucrisa)。Eucrisa是Anacor公司(2016年5月被辉瑞收购)开发的一款非甾体PDE4抑制剂,2016年12月被FDA批准用于治疗2岁及以上儿童和成人患者轻度至中度特应性皮炎(AD),2020年3月又被FDA批准将治疗轻度至中度AD儿童患者的最低年龄限制从24个月扩展至3个月。
目前,度普利尤单抗在国内共递交了三个上市申请,据其在国内的临床试验进展及国外适应症获批情况,笔者推测此次该药申报的适应症是哮喘。
AD领域竞争激烈,Dupixent能否挺住?
Dupixent在特应性皮炎(AD)领域面临着激烈的竞争,尤其是来自JAK抑制剂。其中礼来/Incyte的JAK1/2抑制剂Olumiant(Baricitinib)已于2020年10月被EMA批准用于治疗AD,不过据BREEZE-AD4和BREEZE-AD5临床研究结果,Dupixent在有效性和安全性方面,都对Olumiant具有压倒性优势。艾伯维的Rinvoq和辉瑞的Abrocitinib也已递交治疗AD的新药申请。
艾伯维JAK抑制剂Rinvoq对Dupixent的威胁最大,其与Dupixent头对头治疗中度至重度AD成人患者的3b期研究Heads Up已取得顶线结果。数据显示:Rinvoq(30mg,口服,每日一次)与Dupixent(300mg,皮下注射,每周一次)相比,在主要终点方面疗效更优:治疗第16周,达到EASI75(湿疹面积及严重程度指数至少改善75%)的患者比例更高(71% vs 61%)。次要终点上,与Dupixent组相比,Rinvoq组患者在早期瘙痒和皮损清除改善方面有更高的疗效:治疗1周后,Rinvoq组瘙痒(采用最严重瘙痒数值评分表[NRS]衡量)减少31%(Vs Dupixen组9%);治疗2周后,Rinvoq组有44%的患者达到EASI 75缓解(Vs Dupixent组18%)。不过,今年4月艾伯维宣布Rinvoq治疗AD的补充新药申请遭FDA推迟,预计今年第三季度将收到FDA回复。辉瑞Abrocitinib治疗AD的新药申请正在欧美进行审查,其与Dupixent头对头研究JADE COMPARE的结果显示,Abrocitinib与Dupixent相当。
此外,我国瑞石生物自主研发的JAK1抑制剂SHR0302治疗AD的II期临床研究QUARTZ2(NCT04162899)于去年10月获得成功,达到研究主要及次要终点。
除了JAK抑制剂,在AD领域,Dupixent还面临着其他类型药物的竞争,如Maruho公司IL-31RA靶向单抗nemolizumab、LEO Pharma的IL-13靶向单抗tralokinumab、诺华IL-17C靶向单抗MOR106、协和麒麟OX40靶向单抗KHK4083。
► nemolizumab是中外制药研制的一种人源化单克隆抗体,靶向阻断IL-31受体A,2016年9月Maruho公司获得其在日本市场用于治疗皮肤疾病的开发和商业化权利。
► tralokinumab是一种全人IgG4单克隆抗体,通过强效、特异性中和白细胞介素13(IL-13)发挥作用。该药是LEO Pharma从阿斯利康授权获得,2020年7月美国FDA受理其治疗成人AD的生物制品许可申请。
► MOR106是一种单克隆抗体药物,靶向结合白介素17C(IL-17C)。2018年9月,诺华与Galapagos NV和MorphoSys AG就实验性抗炎药MOR106达成一项高达11.1亿美元的独家许可协议生效。获得MOR106治疗AD及所有其他潜在适应症的独家全球开发和商业化权利。
► KHK4083是一种潜在同类首 款(first-in-class)抗OX40全人单克隆抗体,由协和麒麟发现,利用公司获得专利的POTELLIGENT®去岩藻糖基化(defucosylation)技术生产,以增强其抗体依赖性细胞**(ADCC)活性。今年2月,KHK4083治疗中度至重度AD成人患者的2期研究达到主要终点。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030