https://www.cphi.cn 2023-01-05 14:46 来源:CPHI制药在线 作者:忆
据公开资料,2022年FDA批准了37款新药,其中包括22款新分子实体和15款生物制品。
纵观这些新药,至少有25款新药在美国药物审评史上具有重要意义,其中涉及9个化药,5款单抗,3款双抗,2款基因疗法,1款TCR疗法、ADC、多肽等。企业上看,大型跨国药企BMS占据3款,赛诺菲和罗氏各占据2款,礼来、诺华、吉利德、强生和勃林格殷格翰各占据1款。
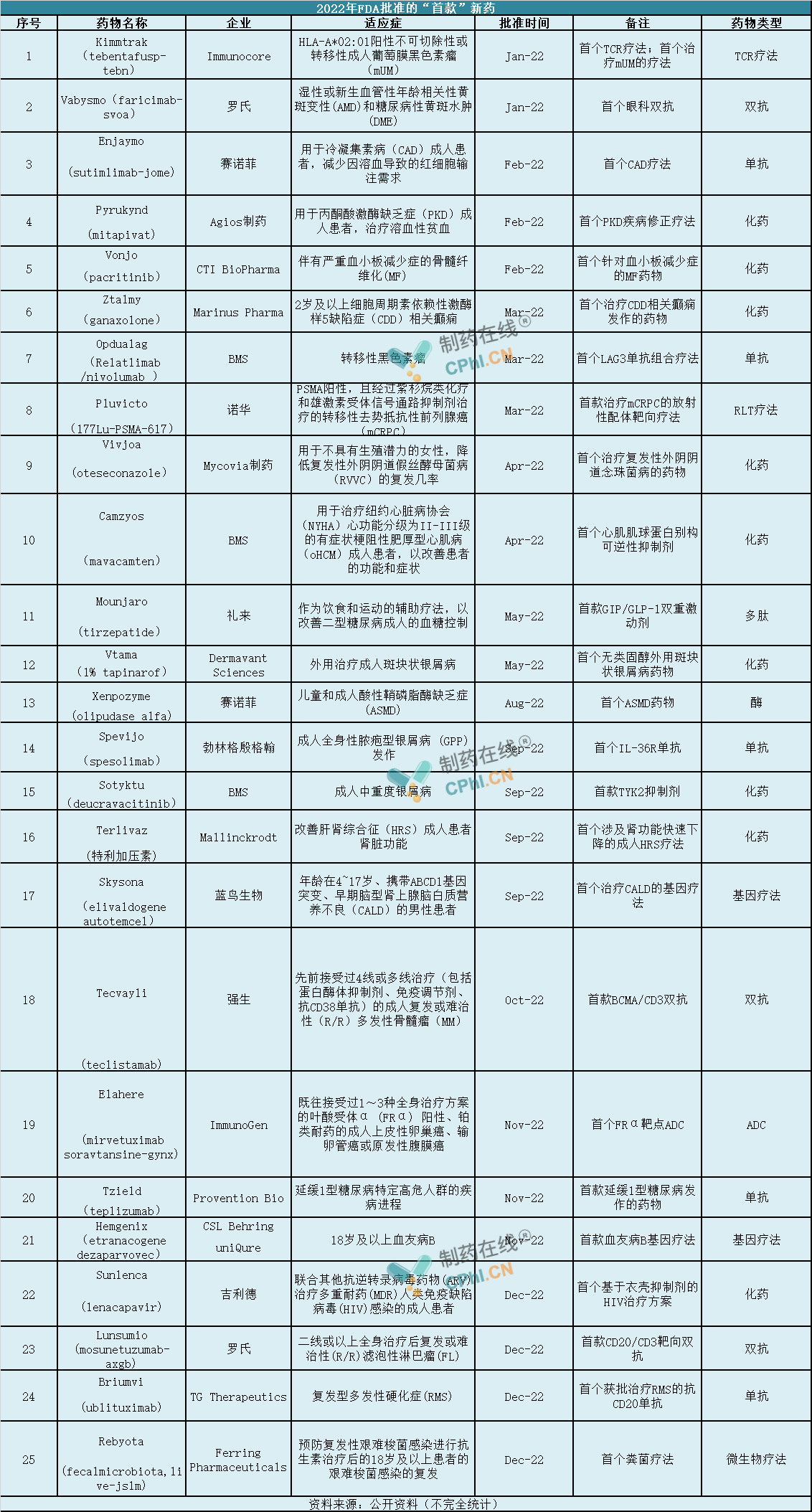
首 款TCR疗法、粪菌疗法问世
1.Kimmtrak(tebentafusp-tebn)
2022年1月,FDA批准Kimmtrak(tebentafusp-tebn,IMCgp100)用于治疗HLA-A*02:01阳性不可切除性或转移性葡萄膜黑色素瘤(mUM)成人患者。
Kimmtrak活性药物成分tebentafusp是一种新型双特异性蛋白,由可溶性TCR与抗CD3免疫效应器结构域融合而成,其被设计成专门靶向gp100(一种在黑色素细胞和黑色素瘤中表达的谱系抗原)。
Kimmtrak的获批创造了多个第一:(1)首 个获FDA批准的TCR疗法;(2)首 个获FDA批准治疗实体瘤的双特异性T细胞接合器;(3)首 个且唯一一个获FDA批准治疗不可切除性或转移性mUM的疗法。
2.Rebyota(fecalmicrobiota,live-jslm)
2022年11月,FDA批准Rebyota(fecalmicrobiota,live-jslm)用于降低18岁以上成年人艰难梭菌感染(CDI)后的复发。
Reybota是一种单剂量灌肠剂,由供体粪便中提取的肠道细菌样本制成,不含任何抗生素,旨在帮助患者恢复肠道微生物群落,并避免CDI的再次感染。此次获批使Reybota成为首 款经FDA批准的粪菌疗法。
冷凝集素病、丙酮酸激酶缺乏症等疾病喜迎首 个治疗药物
1.Enjaymo(sutimlimab-jome)
2022年2月,FDA批准Enjaymo(Sutimlimab-jome)用于治疗冷凝集素病(CAD)。
冷凝集素病溶血是经典补体途径驱动的。而Enjaymo是一款特异性靶向补体C1s蛋白的单克隆抗体,通过阻断经典补体通路中C1s蛋白的功能,抑制患者因补体蛋白激活导致的溶血而发挥作用。Enjaymo是FDA批准的首 款用于冷凝集素病的药物。
2.Pyrukynd(mitapivat)
2022年2月,FDA批准PK(丙酮酸激酶)激活剂Pyrukynd(mitapivat)治疗患有PK缺乏症,且出现溶血性贫血的成人患者。
丙酮酸激酶缺乏症是一类罕见的遗传病,会导致患者出现慢性的溶血性贫血。其背后原因在于PKLR基因突变,影响到了红细胞的丙酮酸激酶活性,从而降低其ATP水平,并使上游代谢产物不断累积,造成红细胞的能量缺失。
Pyrukynd是一款"first-in-class"的口服丙酮酸激酶激活剂,此次获批使其成为丙酮酸激酶缺乏症的首 个疾病修正疗法。
3.Vonjo(pacritinib)
2022年2月,FDA批准Vonjo(pacritinib)用于治疗伴有严重血小板减少症的骨髓纤维化患者。
Vonjo是第一个专门针对成人细胞减少骨髓纤维化治疗的药物,它是一款新型口服激酶抑制剂,对JAK2和IRAK1具有特异性,有助于多种细胞因子的信号传导和生长,对造血功能有很重要的作用。
4.Ztalmy(ganaxolone)
2022年3月,FDA批准Ztalmy(ganaxolone,加奈索酮)口服混悬剂用于2岁及以上患者,治疗与细胞周期蛋白依赖性激酶样5(CDKL5)缺乏症(CDD)相关的癫痫发作。
CDKL5缺乏症(CDD)是一种严重而罕见的遗传性癫痫,其特征是发病早,癫痫发作难以控制,神经发育严重受损。CDD由位于X染色体上的细胞周期蛋白依赖性激酶样5(CDKL5)基因突变引起。
Ztalmy是FDA批准的第一个专门用于治疗CDD的药物,它是一种神经活性类固醇,作为GABAA受体的正向变构调节剂发挥作用。
5.Vivjoa(oteseconazole)
2022年4月,FDA批准口服唑类抗真菌药物Vivjoa,用于降低无生殖潜力的女性复发性外阴阴道假丝酵母菌病(RVVC)的复发率。
RVVC,又称慢性酵母菌感染,通常定义为患者每年发生3次以上有症状的酵母菌感染急性发作,主要症状包括阴道瘙痒、灼热、刺激和炎症,部分患者还会出现阴道分泌物异常,以及性 交或排尿疼痛。
Vivjoa是FDA批准的首 款RVVC疗法,它是一款口服给药的真菌CYP51抑制剂。与目前可用的抗真菌药物相比,Vivjoa具有更高的选择性、更少的副作用和更高的疗效。
6.Xenpozyme(olipudase alfa)
2022年8月,FDA批准Xenpozyme用于治疗儿童和成人患者的酸性鞘磷脂酶缺乏症(ASMD)的非中枢神经系统疾病。
酸性鞘磷脂酶缺乏症(ASMD)是一种罕见的、进行性遗传病,患者由于编码鞘磷脂代谢酶的基因突变,导致鞘磷脂无法分解,鞘磷脂积聚在肝 脏、脾 脏、肺和大脑等部位,体征、症状包括脾 脏或肝 脏肿大、呼吸困难、肺部感染、不寻常的瘀伤或出血,导致疼痛、呕吐、喂养困难和跌倒,以及其他疾病表现。
Xenpozyme是FDA批准的首 个用于非中枢神经系统表现的治疗ASMD的药物
7. Terlivaz(特利加压素)
2022年9月,FDA批准Terlivaz上市,用于治疗肾功能快速恶化的成人肝肾综合征。
肝肾综合征(HRS)是一种急性且可能危及生命的疾病,常见于晚期肝病患者。患者由于血流动力学异常,最终导致内脏和全身血管舒张,可能引发门静脉高压并导致肾血管收缩。而收缩功能不全导致的心输出量不足会增加肾功能衰竭的风险。肝移植目前是HRS患者的唯一治愈办法,但肝移植可遇不可求,且患者往往来不及进行肝移植。
Terlivaz是全球首 款获FDA批准用于改善HRS成人患者肾 脏功能的药物,它是血管加压素的一种合成类似物,具有收缩血管作用,可降低肝 脏血流量和门静脉压,并同时增加有效的动脉血量与平均动脉压(MAP)。该药物对血管加压素V1受体有较V2受体约2倍的选择性。
8.Skysona(elivaldogene autotemcel)
2022年9月,FDA加速批准Skysona 上市,用于减缓患有早期活动性脑肾上腺脑白质营养不良(CALD)的4-17岁男孩神经功能障碍的进展。
CALD是一种进行性和不可逆的神经退行性疾病,由ABCD1基因突变引起的,影响肾上腺脑白质营养不良蛋白(ALDP)的产生,并随后导致超长链脂肪酸(VLCFA)的毒 性积累,主要在肾上腺和脑白质和脊髓。
Skysona是首 个且唯一一个获监管批准用于治疗CALD的一次性基因疗法,利用Lenti-D慢病毒载体(LVV)进行体外转导,将ABCD1基因的功能拷贝添加到患者自身的造血干细胞(HSC)中。功能性ABCD1基因的加入能使患者体内产生ALD蛋白(ALDP),这被认为有助于VLCFA的分解。
9.Tzield(teplizumab)
2022年11月,FDA批准Tzield上市,用于延缓2期1型成人及8岁以上儿童糖尿病患者进展为3期1型糖尿病。
Tzield是全球首 款延缓1型糖尿病进展药物,它是一种抗CD3单抗,通过与某些免疫系统细胞(效应T细胞)表面的CD3结合,抑制T细胞对胰岛β细胞的攻击,从而保护胰岛β细胞不受破坏。Tzield可能会使攻击胰岛素分泌细胞的免疫细胞失活,同时增加有助于调节免疫反应的细胞比例,因此可以延缓1型糖尿病患者疾病进展为3期。
多个靶点喜迎新药上市
1.Opdualag(Relatlimab/nivolumab)
2022年3月,FDA批准Opdualag上市,用于治疗12岁以上患有不可切除或转移性黑色素瘤的成人和儿童。Opdualag是BMS开发的一款双免疫疗法Relatlimab+ Nivolumab 固定剂量组合药物,其中Relatlimab是一款靶向淋巴细胞活化基因3(LAG3)的单抗药物,Nivolumab则是BMS的重磅产品全球首 个获批的PD-1单抗Opdivo。
Opdualag是首 款获FDA批准的 LAG3 单抗组合疗法,已公布的3期临床试验结果显示:与纳武利尤单抗单药治疗相比,Opdualag的中位无进展生存期可延长一倍以上。
2.Camzyos(Mavacamten)
2022年4月,FDA批准Camzyos上市,用于治疗纽约心脏协会(NYHA)II-III类症状性的梗阻性肥厚型心肌病的成人,以改善功能能力和症状。阻塞性肥厚性心肌病是一种心肌增厚并削弱其泵血能力的疾病。
Camzyos是第一种治疗梗阻性肥厚型心肌病的药物,它是一种新型心肌肌球蛋白的小分子变构调节剂,可通过抑制肌钙-肌球蛋白结合,阻止肌桥形成,从而改善HCM患者的心肌收缩功能亢进,进而改善心肌舒张功能和患者的临床结局。
3.Mounjaro(tirzepatide)
2022年10月,FDA批准Mounjaro辅助饮食和运动,用于改善2型糖尿病(T2D)成人患者的血糖控制。
Mounjaro是FDA批准的首 个且唯一一个GIP/GLP-1受体激动剂,也是近10年来获批上市的首 个新型降糖药物。全球多中心3期临床试验SURPASS结果显示:与所有对照组相比,Mounjaro组实现了血糖降低,且减重效果显著。
4.Spevijo(spesolimab)
2022年9月,FDA批准Spesolimab上市,用于治疗成人泛发性脓疱型银屑病 (GPP) 发作。GPP是一种罕见的、异质性的、可危及生命的嗜中性粒细胞性皮肤病,与斑块状银屑病不同。GPP是由中性粒细胞(一种白细胞)在皮肤中积聚引起的,会在全身广泛爆发疼痛性的无菌性脓疱。
Spevigo是一款靶向IL-36R的人源化单抗。IL-36通路是免疫系统内的一种信号通路,已被证明与GPP等多种自身免疫性疾病的发病机制病因有关。此次获批使Spevigo成为FDA批准的首 款GPP疗法,同时也是全球批准的首 款IL-36单抗。
5.Sotyktu(deucravacitinib)
2022年9月,FDA批准Sotyktu用于治疗适合全身治疗或光疗的中度至重度斑块型银屑病患者。
Sotyktu(氘可来昔替尼)是全球唯一获批的TYK2抑制剂,通过选择性与TYK2蛋白调控结构域结合,使TYK2处于失活状态,从而选择性抑制TYK2的活性,并避免抑制蛋白JAK1、JAK2或JAK3,进而避免相关心血管事件或静脉血栓栓塞不良事件的发生。
其获批基于的2项关键3期临床试验结果显示:第16周时,与安慰剂组和阿普米司特组相比,氘可来昔替尼组在两项试验中的PASI 75(银屑病面积与严重程度指数改善至少75%)的患者比例分别为58.7%和53.6%,而安慰剂组和阿普米司特组分别为12.7%和9.4%,以及35.1%和40.2%。
6.Tecvayli(teclistamab)
2022年11月,FDA批准Tecvayli用于治疗先前接受过4线或多线治疗(包括蛋白酶体抑制剂、免疫调节剂、抗 CD38 单抗)的复发或难治性(R/R)多发性骨髓瘤(MM)成人患者。
Tecvayli是全球批准的首 个BCMAxCD3靶向双抗,也是第一个获批治疗MM的双抗。该药是一种即用型产品,通过皮下注射给药。其获批的关键1/2期MajesTEC-1研究结果显示:Tecvayli治疗的ORR为61.8%,其中28.2%的患者达到完全缓解(CR)或更好缓解。在病情缓解的患者中,从治疗到首次确认缓解的中位时间为1.2个月(范围为0.2-5.5个月)。中位随访时间为7.4个月,中位缓解持续时间(DOR)尚未达到。
7.Elahere(mirvetuximab soravtansine-gynx)
2022年11月,ImmunoGen宣布FDA批准Elahere用于治疗叶酸受体α(FRα)阳性且既往接受过1-3线全身治疗方案的铂耐药卵巢上皮性癌、输卵管癌或原发腹膜癌的成年患者。
Elahere是全球批准的首 个FRα靶点抗体偶联药物(ADC),包括FRα结合抗体、可裂解的连接子和美登木素生物碱DM4(一种强效的微管蛋白靶向剂)。其关键性SORAYA试验结果显示:研究者评估的ORR为31.7%,包括5例CR,中位DOR为6.9个月。
8.Lunsumio (mosunetuzumab-axgb)
2022年12月,FDA批准Lunsumio上市,用于治疗二线或以上全身治疗后复发或难治性(R/R)滤泡性淋巴瘤(FL)患者。
Lunsumio是FDA批准的首 个CD20xCD3 T细胞结合双抗,旨在靶向B细胞表面的CD20和T细胞表面的CD3。这种双重靶向激活并重定向患者现有的T细胞,通过释放细胞毒 性蛋白进入B细胞,参与并消除靶B细胞。
该药获批的2期GO29781研究数据显示:在接受Lunsumio治疗的患者中,ORR达到80%,其中多数患者的缓解持续时间至少为18个月。缓解者的中位缓解持续时间几乎为2年(22.8个月)。60%的患者达到完全缓解。
多种疾病喜迎新疗法,涉及药物类型和作用靶点
1.Vabysmo(faricimab-svoa)
2022年1月,FDA批准Vabysmo用于治疗湿性老年性黄斑变性(AMD)和糖尿病性黄斑水肿(DME)。
Faricimab是全球批准的首 个眼科双抗,通过中和血管生成素-2 (Ang-2)和血管内皮生长因子-A (VEGF-A),靶向并抑制与许多威胁视力的视网膜疾病相关的两种疾病途径。与单纯抗VEGF疗法相比,Faricimab用干治疗多种视网膜疾病可以实现减少眼部注射给药频率,改善患者的远期视力结局。
2.Pluvicto(177Lu-PSMA-617)
2022年3月,FDA批准靶向放 射 性配体疗法Pluvicto上市,用于治疗前列腺特异性膜抗原(PSMA)阳性、转移性去势抵抗性前列腺癌(mCRPC)患者。
Pluvicto是首 款被FDA批准的用于治疗这类mCRPC患者的靶向放射配体疗法,它一种结合了靶向性配体与放 射 性同位素疗法,靶向到PSMA阳性细胞,通过放射 性同位素导致DNA损伤以杀伤肿瘤细胞。
其获批依据一项3期临床试验结果显示:与标准治疗(SOC)相比,接受Pluvicto治疗的患者将死亡风险降低38%;Pluvicto组的总缓解率为30%,对照组仅为2%。
3.Vtama(tapinarof)
2022年5月,FDA批准Vtama(tapinarof)乳膏上市,用于成人斑块型银屑病的局部治疗,这使Vtama成为同类产品中首 个获得FDA批准的无类固醇外用药物。
Vtama的活性成分tapinarof是一种芳香烃受体调节剂,作为一种非激素类小分子药物,具有良好的皮肤渗透性,通过调节芳香烃受体的功能,能够抑制IL-17介导的炎症反应(IL-17信号通路是治疗银屑病的"关键靶点 ")。
4.Hemgenix (etranacogene dezaparvovec)
2022年11月,FDA批准Hemgenix用于治疗18岁及以上血友病B。
Hemgenix是FDA批准的首 款治疗血友病B成人患者的基因疗法,它一款基于AAV5载体的基因疗法,搭载有凝血因子IX(FIX)基因变体,通过静脉给药,给药后该基因可在肝 脏中表达FIX 凝血因子,分泌后进入血液发挥凝血功能,从而达到治疗目的,理论上一次给药长期有效。
5.Sunlenca(lenacapavir)
2022年12,FDA批准Sunlenca(lenacapavir)联合其它抗逆转录病毒 药物,用于治疗多重耐药人类免疫缺陷病毒(HIV)感染的成人患者。
Sunlenca是一种首 创的长效HIV衣壳抑制剂,为当前治疗方案不能充分控制的HIV成人患者提供了一种新的、每年两次的治疗选择。其获批依据的2/3期CAPELLA临床试验数据显示:接受Sunlenca治疗的患者中有88%(n=21/24)的人实现了病毒的减少,而接受安慰剂治疗的患者中只有17%(n=2/12).的人实现了病毒的减少。在Sunlenca加其他抗逆转录药物治疗26周后,第一组中81%的参与者实现了HIV RNA抑制,其中HIV的水平低到足以被认为检测不到。
6.Briumvi(ublituximab)
2022年12月,FDA批准Briumvi用于治疗复发型多发性硬化症(RMS),包括成人的临床孤立综合征、复发缓解型疾病和活动性继发性进展性疾病。
Briumvi是首 个且唯一一个获批用于治疗RMS的抗CD20单抗,靶向B细胞表达的CD20抗原上的独特抗原表位。Briumvi与B细胞结合时可引发抗体依赖性细胞毒 性(ADCC)和补体依赖性细胞毒 性(CDC)等一系列免疫反应,从而摧毁B细胞。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030