https://www.cphi.cn 2023-02-16 14:00 来源:药渡Daily 作者:一叶莲心
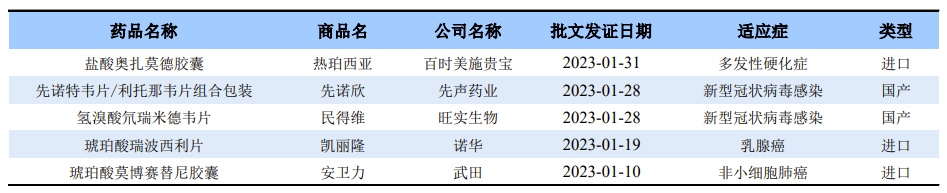
在开年来的第一个月内,已经有5款新药在国内成功获批,分别是武田制药的琥珀酸莫博赛替尼胶囊(安卫力®)、诺华制药的琥珀酸瑞波西利片(凯丽隆®)、旺实生物的氢溴酸氘瑞米德韦片(民得维®)、先声药业的先诺特韦片/利托那韦片组合包装(先诺欣®)和百时美施贵宝的盐酸奥扎莫德胶囊(热珀西亚®)。
注:由于艾迪药业的艾诺米替片批文发证日期为2022年12月30日,故不纳入统计。
图片来源:药渡数据库
国内首 款肺癌EGFR 20ins靶向药
琥珀酸莫博赛替尼胶囊
2023年1月11日,NMPA官网最新公告显示,武田(Takeda)申报的1类新药琥珀酸莫博赛替尼胶囊(Mobocertinib)已通过NMPA的优先审评程序附条件获批上市,用于含铂化疗期间或之后进展且携带表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。这是国内首 款用于EGFR Exon20插入突变NSCLC的新药,对国内肺癌患者具有重大的意义。
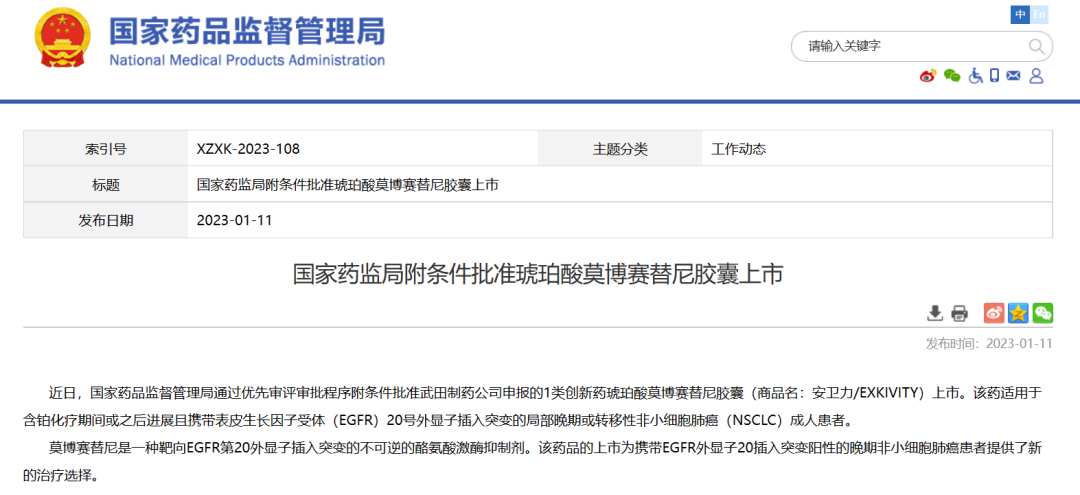
莫博赛替尼是一种Ariad和武田合作开发的新一代强效口服小分子酪氨酸激酶(TKIs)抑制剂,被专门设计用于选择性靶向EGFR外显子20插入突变。2021年9月15日,Mobocertinib获FDA加速批准上市,商品名EXKIVITY®,用于治疗含铂化疗期间或之后疾病进展的伴表皮生长因子受体(EGFR)外显子20插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者,这也是全球首 个也是唯一获批的针对EGFR外显子20插入突变的药物。
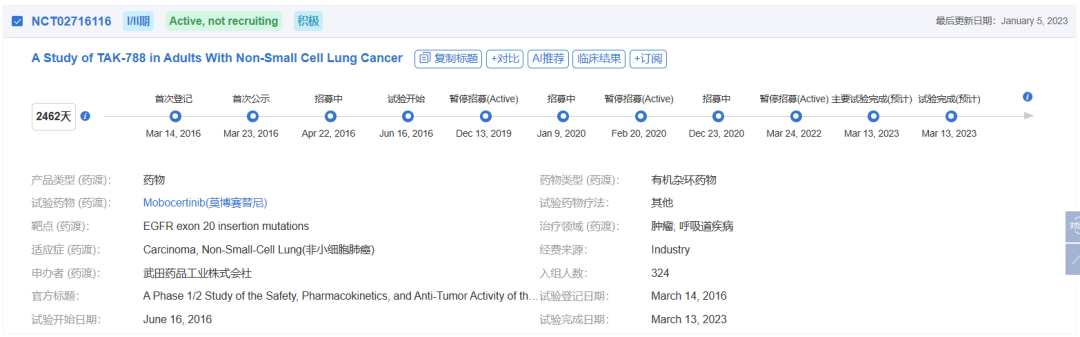
莫博赛替尼的获批主要基于1/2期研究(NCT02716116)结果,临床数据显示,莫博赛替尼160mg QD治疗114例铂类化疗经治患者(PPP队列,包括6例剂量递增队列+22例剂量扩展队列1+86例EXCLAIM队列患者),独立审查委员会(IRC)确认的ORR为28%,研究者确认的ORR为35%。并且,无论插入突变发生在近环(near-loop)或远环(far-loop),ORR都相似,分别为29%和25%。莫博赛替尼起效迅速且疗效持久,中位起效时间为1.9个月,中位缓解持续时间(DoR)为17.5个月。中位OS为24个月,中位无进展生存期(PFS)为7.3个月。
图片来源:药渡数据库
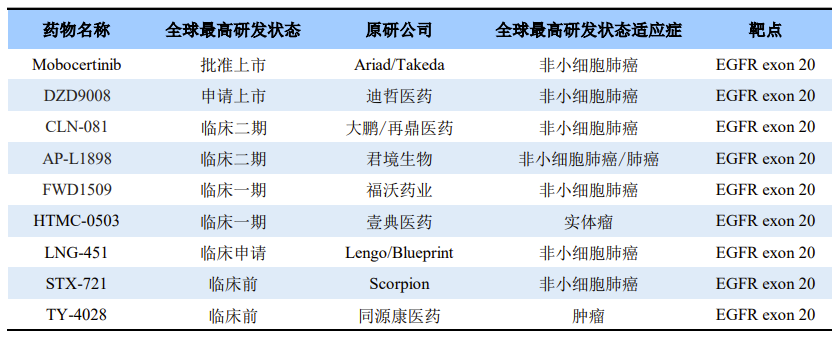
目前全球有多家企业布局EGFR 20号外显子插入突变抑制剂,国内布局EGFR 20号外显子插入突变抑制剂的企业也有多家。其中,进展最快的是迪哲医药的舒沃替尼(DZD9008),迪哲医药已经向CDE提交NDA并已于2023年1月10日获CDE正式受理,根据公布的临床试验数据,可看出该药具有非常优秀的市场潜力(数据来自中国注册临床研究:WU-KONG6);其次进展较快的是大鹏/再鼎医药的CLN-081、君境生物的AP-L1898,目前最高研发状态为临床2期;福沃药业的FWD1509和壹典医药的HTMC-0503处于1期临床阶段。
图片来源:药渡数据库
国内首 个晚期一线绝经前乳腺癌疗法
琥珀酸瑞波西利片
2023年1月19日,诺华发布消息,其乳腺癌治疗产品凯丽隆® (琥珀酸瑞波西利片)获中国国家药品监督管理局批准,与芳香化酶抑制剂联合用药,作为激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性局部晚期或转移性乳腺癌绝经前或围绝经期女性患者的初始内分泌治疗,使用内分泌疗法治疗时应联用黄体生成素释放激素(LHRH)激动剂。信息显示,这是目前国内唯一获批晚期一线绝经前适应症的CDK4/6抑制剂。

据世界卫生组织国际癌症研究机构发布的2020年全球最新癌症数据,全球乳腺癌新发病例高达226万例,已取代肺癌成为全球第一大癌种。在中国,乳腺癌是女性常见的恶性肿瘤之一,发病率位居女性恶性肿瘤之首。而这个群体中,有约70%的患者为激素受体阳性(HR+)、人表皮生长因子受体2阴性(HER2-)乳腺癌。疾病的复杂性给这类晚期乳腺癌治疗带来了巨大挑战,亟需创新的治疗方式。内分泌治疗是HR+/HER2-晚期乳腺癌经典的系统性治疗手段,然而,仍然有患者难免会出现原发或继发耐药,使得内分泌治疗疗效大打折扣。随着内分泌治疗联合分子靶向治疗的开展,CDK4/6抑制剂越来越成为其中的“重头戏”。
瑞波西利分子结构式
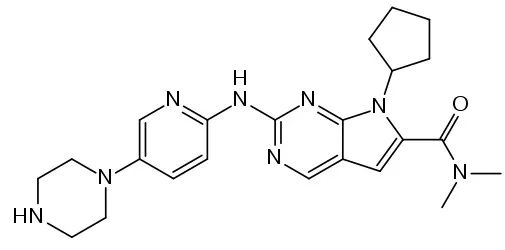
瑞波西利是拥有非常大规模临床试验证据的CDK4/6抑制剂。MONALEESA全球研究包括诺华申报的三项试验,其中MONALEESA-7研究结果提示,与内分泌治疗相比,瑞波西利内分泌治疗作为绝经前HR+/HER2-晚期乳腺癌(ABC)患者的初始治疗,无进展生存期(PFS)和总生存期(OS)具有统计学的显著获益。尽管MONALEESA-7研究显示亚洲患者OS获益(HR 0.609)ITT人群一致,但仍缺乏针对中国绝经前HR+/HER2- ABC患者的循证医学证据。为此,该药在中国大陆开展了一项瑞波西利的多中心2期桥接研究。
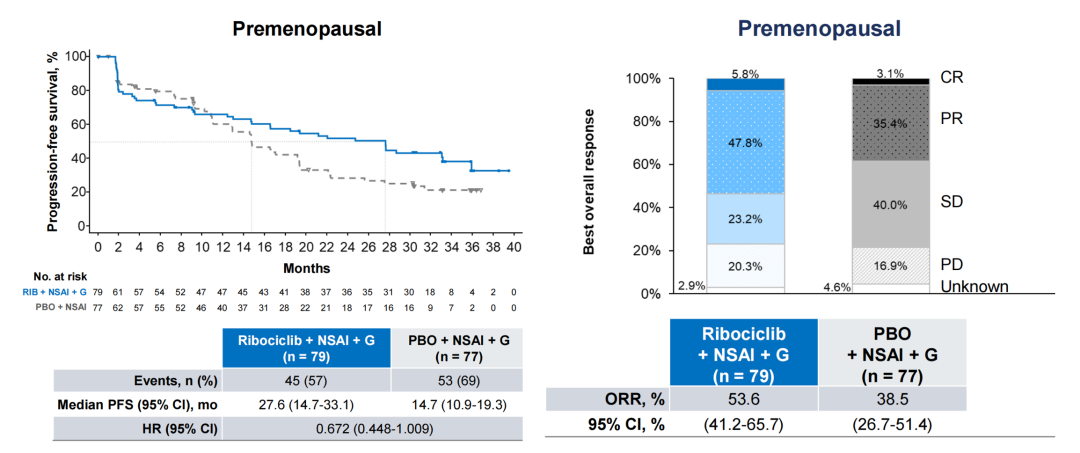
在这项桥接研究中,有156例初始治疗的绝经前HR+/HER2- ABC患者被纳入绝经前队列,随机(1:1)接受瑞波西利或安慰剂+NSAI+OFS(戈舍 瑞林),研究结果显示达到了主要终点:瑞波西利组的PFS相较于安慰剂组延长了12.9个月(27.6 vs 14.7个月),疾病进展或死亡风险降低32.8%(HR 0.672,95%CI:0.448~1.009)。在次要终点方面,瑞波西利组的ORR相较于安慰剂组提高了15.1%(53.6% vs 38.5%),OS尚未成熟。在安全性方面,该桥接研究中瑞波西利的总体安全性与已知的安全性特征大致相似,并与全球研究(MONALEESA-7)基本一致,没有发生新的不良事件。
截止目前,国内已上市5款CDK4/6抑制剂新药,除去诺华的瑞波西利,其他4款分别为2018年7月批准的辉瑞“哌柏西利”,2020年12月批准的礼来“阿贝西利”,2021年12月批准的恒瑞医药“达尔西利”和2022年7月批准的先声药业从G1 Therapeutics引进的“曲拉西利”。
国内还有数十款CDK4/6抑制剂在临床研究阶段,除了创新药间的竞争外,仿制药的入局或将给CDK4/6赛道带来巨大的变数。哌柏西利的专利将于2023年到期,齐鲁制药的哌柏西利首仿已于2020年12月获批上市,目前已有13个哌柏西利仿制批文获批。CDK4/6抑制剂赛道的仿制药VS创新药,创新药VS创新药的混战已经来袭。
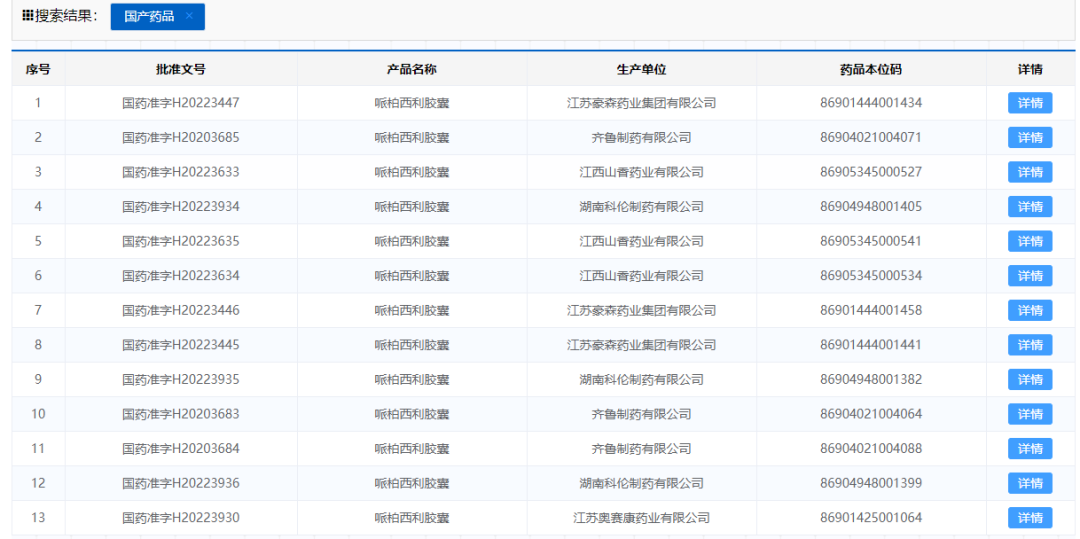
图片来源:NMPA官网
头对头PAXLOVID,效果不输
氢溴酸氘瑞米德韦片
2023年1月28日,旺实生物(君实生物和旺山旺水的合资子公司)口服核苷类抗新冠病毒 药物氢溴酸氘瑞米德韦片(商品名:民得维®,VV116)获得国家药品监督管理局(NMPA)批准上市,用于治疗轻中度新型冠状病毒感染的成年患者。
瑞米德韦(VV116)是一款我国自主研发的口服核苷类抗病毒 药物,可抑制SARS-CoV-2复制,原理是通过靶向RNA依赖的RNA聚合酶(RdRp)抑制病毒RNA合成,与瑞德西韦、阿兹夫定、莫诺拉韦同一靶点。VV116在研发过程中采用了氘代策略,设计灵感来自于瑞德西韦,VV116从瑞德西韦优化而来,保留了瑞德西韦的抗病毒活性,并能够口服给药。临床前的药代动力学等研究结果显示,VV116具有很高的口服生物利用度,口服吸收后水解为母体核苷(氘GS-441524)。
VV116体内代谢为活性化合物的过程

2022年12月29日,国际顶级医学期刊《新英格兰医学杂志》(The New England Journal of Medicine,NEJM,影响因子:176.079)在线发表了一项中国非劣效性3期随机对照临床试验(NCT05341609),其结果表明,对于有高危因素的轻中度Covid-19成人患者,在至持续临床康复时间方面,口服核苷类抗新冠病毒 药物VV116非劣于奈玛特韦片/利托那韦片组合药物Paxlovid(4天 vs. 5天;风险比:1.17;95%置信区间:1.02~1.36),且不良事件更少。

2023年2月3日,四川省医疗保障局正式公示上海旺实生物医药科技有限公司自主申报的氢溴酸氘瑞米德韦片(商品名:民得维®)首 发报价,每疗程795元的新款国产新冠治疗药品有望快速进入中国市场。

截止目前国内一共有5款新冠小分子口服药上市,分别是Paxlovid(奈玛特韦片/利托那韦片组合包装),阿兹夫定片,莫诺拉韦胶囊(商品名:利卓瑞®/LAGEVRIO®),氢溴酸氘瑞米德韦片(商品名:民得维®)和先诺特韦片/利托那韦片组合包装(商品名:先诺欣®)。国产新冠口服药物定价均大幅低于进口新冠口服药,同时疗效方面也有非常确切的证据,为我国抗击疫情提供了坚实后盾。
首 个国产3CL靶点新冠口服药
先诺特韦片/利托那韦片组合包装
2023年1月28日,由中国科学院上海药物研究所、中国科学院武汉病毒研究所联合先声药业合作研发的抗新冠病毒创新药先诺欣®获国家药品监督管理局通过特别审批程序,进行应急审评审批,附条件批准上市,用于治疗轻中度新型冠状病毒感染(COVID-19)成年患者。这是我国首 款自主研发的靶向3CL蛋白酶的抗新冠病毒口服药物。

先诺欣®是一款口服小分子抗新冠病毒创新药,是先诺特韦片与利托那韦片的组合包装药物,其中先诺特韦针对SARS-CoV-2病毒复制必须的3CL蛋白酶(和辉瑞Paxlovid同个靶点),与低剂量利托那韦联用有助于减缓先诺特韦在体内的代谢或分解,提高抗病毒效果。已完成的临床前研究显示,先诺欣®具有高活性、低毒 性、依从性高等特性。
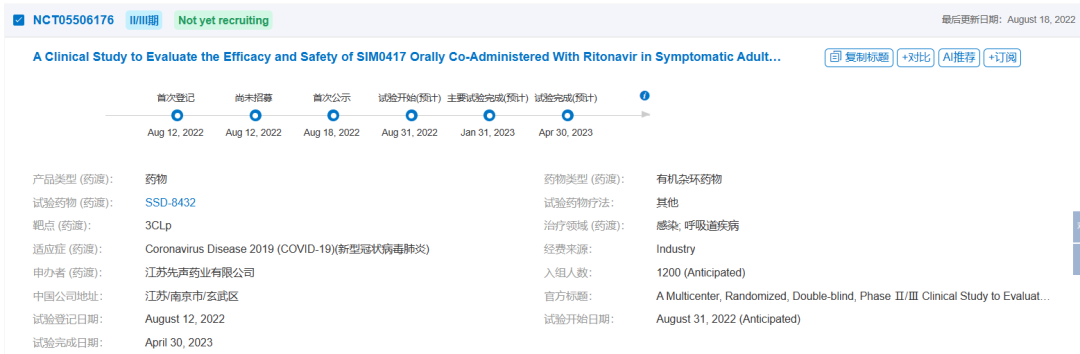
先诺欣®的获批主要基于注册性3期临床试验(NCT05506176),这是一项评估先诺欣®治疗轻中度COVID-19成年感染者的有效性和安全性多中心、随机、双盲、安慰剂对照的注册性临床研究,本项研究计划共招募1208名患者,2022年12月16日已完成全部患者入组。
图片来源:药渡数据库
研究结果证实,先诺欣®对中国轻至中度COVID-19成年患者安全有效,有显著的临床疗效。加快症状恢复,缩短病程:在1208例有症状的轻中度COVID-19成年患者中,相较安慰剂,先诺欣®显著缩短11种目标COVID-19症状首次达到持续恢复时间约1.5天,其中重症高风险亚组人群显著缩短约2.4天,同时临床数据提示尽早使用先诺欣®疗效更优。目前先诺欣的最新定价为750元/盒,价格远低于辉瑞的Paxlovid,非常具有性价比。当然先诺欣也具有与Paxlovid同样的局限性,多种药物相互作用造成使用受限的情况依然存在,需要非常注意合理用药。
聚焦国产企业,3CL靶点赛道“人才济济”。首先,进展最快的莫过于先声药业的先诺欣®(SIM0417),目前最高研发状态为批准上市;其次前沿生物的FB-2001、众生生物的RAY-1216、广生堂药业的GST-HG171,均处于临床III期研究阶段;歌礼制药的ASC11、西湖大学的Mprosevir、石药集团的SYH-2055均处于I期临床研究阶段;此外,信立泰的SAL-0133已于去年12月提交IND。预计在2023年一年中,将会有至少3款国产3CL靶点药物获批,花落谁家,大家拭目以待。
针对多发性硬化症的S1P受体调节剂
盐酸奥扎莫德胶囊
在2023年02月02日NMPA发布药品批准证明文件送达信息中,百时美施贵宝(BMS)的新药盐酸奥扎莫德胶囊(Ozanimod)在2023年1月31日获得中国国家药品监督管理局(NMPA)批准,用于治疗成人复发型多发性硬化,包括临床孤立综合征、复发-缓解型多发性硬化和活动性继发进展型多发性硬化。奥扎莫德是百时美施贵宝在中国自身免疫疾病领域首 个获批的创新疗法。
奥扎莫德是一款口服选择性S1P受体调节剂,最初由Receptos公司开发,后被BMS子公司新基以73亿美元收购引入。其通过选择性结合S1PR1和S1PR5,降低血液和淋巴循环中的淋巴细胞数目,减少中枢神经系统的炎症反应。2020年3月,奥扎莫德首次获批上市,商品名为Zeposia®,适应症为成人复发型多发性硬化症(RMS)。2021年5月27日,其获FDA批准用于治疗成人中重度溃疡性结肠炎。

此次获批基于SUNBEAM(12个月)和RADIANCE(B部分,24个月)这两项大型阳性药物对照III期研究结果。研究共计纳入了2600多名患者,旨在评估奥扎莫德胶囊(口服,每日一次)对比Avonex®(重组人干扰素β-1a,肌肉注射,每周一次,下简称“干扰素β-1a”)在治疗成人复发型多发性硬化患者中的有效性和安全性。研究结果显示,与干扰素β-1a相比,奥扎莫德可带来显著临床获益。
①年复发率(ARR)降低:与干扰素β-1a相比,持续接受奥扎莫德治疗12个月的患者,其ARR可降低48%;持续治疗24个月,ARR降低38%;
②MRI病灶数减少:与干扰素β-1a相比,持续接受奥扎莫德治疗12个月的患者,其T1加权钆增强(GdE)病灶数减少63%,新发/扩大T2病灶数减少48%;持续治疗24个月,其T1加权钆增强(GdE)病灶数减少53%,新发/扩大T2病灶数减少42%;
③脑容量丢失减少:与干扰素β-1a相比,接受奥扎莫德治疗12个月的患者,其全脑容量丢失减少31%,皮层灰质容量丢失减少84%,丘脑容量丢失减少32%;持续治疗24个月,其全脑容量丢失减少26%,皮层灰质容量丢失减少60%,丘脑容量丢失减少27%;
④认知功能保护:在SUNBEAM研究中,接受奥扎莫德治疗12个月,35.6%患者的符号数字模式测试(SDMT)出现具有临床意义的改善(SDMT评分增加≥4分),高于干扰素β-1a治疗组患者(27.9%);在这两项研究中,奥扎莫德整体安全性和耐受性良好,最常见的不良事件(发生率≥4%)为上呼吸道感染、肝转氨酶升高、直立性低血压、尿路感染、背痛和高血压。
目前全球获批上市的S1P受体调节剂共4款,除去BMS奥扎莫德,其余3款分别是罗氏/强生Ponesimod、诺华西尼莫德和芬戈莫德。国内仅辉瑞/云顶新耀Etrasimod进展较快,已进入3期临床,适应症为中重度活动性溃疡性结肠炎(UC)。Etrasimod由Arena Pharmaceuticals公司开发,辉瑞于今年早前完成了对Arena Pharmaceuticals的收购,而云顶新耀于2017年从Arena获得了在大中华区和韩国开发、生产和商业化Etrasimod的独家权利。Etrasimod已经在2022年12月提交了有关治疗中重度活动性溃疡性结肠炎的FDA上市申请,预计在今年大概率获批。

如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030