2024 年4月26日,烟台东诚药业集团股份有限公司(以下简称“公司”或“上市公司”)控股子公司烟台蓝纳成生物技术有限公司(以下简称“蓝纳成”)收到中国国家药品监督管理局(以下简称“国家药监局”)核准签发的关于177LuLNC1008 注射液的药物临床试验批准通知书,将于近期开展临床试验。 现将177Lu-LNC1008 注射液相关情况公告如下:
一、药物的基本情况
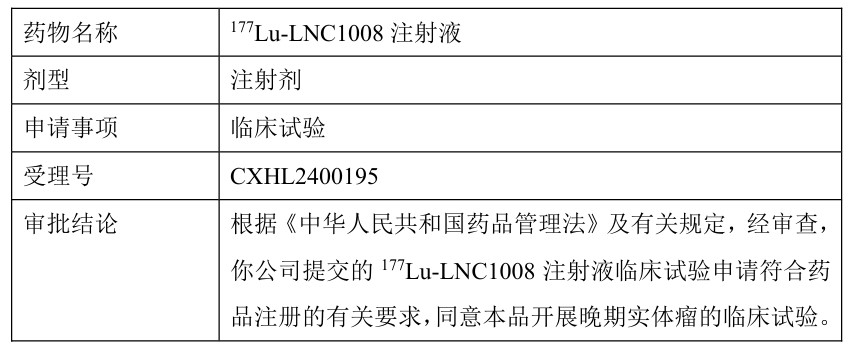
二、药物的其他情况
1、公司在研产品 177Lu-LNC1008 注射液是一种靶向整合素 alpha-v beta-3(αvβ3)蛋白的放 射性体内治疗药物,拟用于治疗整合素alpha-v beta-3(αvβ3)阳性的晚期恶性实体瘤患者,目前在国际和国内尚无同靶点放 射性治疗药物上市。
2、整合素αvβ3是一种重要的细胞表面受体,属于整合素家族,在肿瘤进展中发挥着重要的作用,参与包括肿瘤发生、上皮-间质转化(epithelial-mesenchymal transition, EMT)、血管生成、肿瘤干性、代谢重编程、免疫逃逸、骨转移和耐药等多个相关进程。LNC1008 前体能特异性地与整合素αvβ3结合,通过将放 射性核素镥[177Lu]靶向运送至整合素αvβ3阳性的实体瘤处实现肿瘤的精准治疗。
3、177Lu-LNC1008 注射液除了具有靶向治疗的优势外,通过加入专利化学结构能够改善探针的药代和药效性能,增加肿瘤对药物的有效摄取,延长治疗时间窗并可以在同等或更优的治疗效果下降低放 射性核素的用量,进而降低患者的治疗成本。
目前国内外暂无同产品上市,亦无相关销售数据。截至目前,177Lu-LNC1008注射液相关项目累计已投入研发费用约1,277.45万元。
三、风险提示
根据相关的法律法规要求,177Lu-LNC1008注射液在获得药品临床试验批准/授权通知书后,尚需开展临床试验,待临床试验成功后按程序注册申报并需经官方审评、审批通过后方可上市销售。
药品从研制、临床试验报批到投产的周期长、环节多,药品研发及至上市容易受到一些不确定性因素的影响,敬请广大投资者谨慎决策,注意防范投资风险。公司将按相关国家的有关规定积极推进上述研发项目,并及时对项目后续进展情况履行信息披露义务。
特此公告。
烟台东诚药业集团股份有限公司董事会
2024 年4月29日








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57