
2023年09月15日,全国团体信息平台发布了由上海市医药质量协会组织起草的《药物临床试验申办者质量管理体系建设指南》(T/SHQAP 001—2023)团体标准,该标准2023年10月15日起实施。此《药物临床试验申办者质量管理体系建设指南》团体标准提供了药物临床试验申办者质量管理体系的建设指南,弥补了国内药物临床试验申办者质量管理体系建设指南技术要求和检验领域的空白,为药物临床试验申办者提供了更多的灵活性和参考依据,从而推动技术的进步和创新。
一、法规层面上对申办者的药物临床试验质量管理体系的要求
药物临床试验是药品研发上市中一道重要评价防线,其研究资料和数据是药品上市的主要依据,其质量直接影响到药品质量和公众用药安全。2020年7月1日起开始实施的新修订的《药物临床试验质量管理规范》中明确提出,“申办者应当建立临床试验的质量管理体系”然而,目前我国尚无针对申办者的药物临床试验质量管理体系建设的相关标准及指导原则,从申办者的角度建立药物临床试验质量管理体系,无论对提高药物临床试验的数据可靠性,还是保障受试者的安全,都是必要和必需的。笔者梳理了新版GCP法规层面上对申办者的药物临床试验质量管理体系的要求条款摘录如下:
第三十条 申办者应当建立临床试验的质量管理体系。
(一)申办者的临床试验的质量管理体系应当涵盖临床试验的全过程,包括临床试验的设计、实施、记录、评估、结果报告和文件归档。质量管理包括有效的试验方案设计、收集数据的方法及流程、对于临床试验中作出决策所必需的信息采集。
(二)临床试验质量保证和质量控制的方法应当与临床试验内在的风险和所采集信息的重要性相符。申办者应当保证临床试验各个环节的可操作性,试验流程和数据采集避免过于复杂。试验方案、病例报告表及其他相关文件应当清晰、简洁和前后一致。
(三)申办者应当履行管理职责。根据临床试验需要可建立临床试验的研究和管理团队,以指导、监督临床试验实施。研究和管理团队内部的工作应当及时沟通。在药品监督管理部门检查时,研究和管理团队均应当派员参加。
二、《药物临床试验申办者质量管理体系建设指南》标准信息
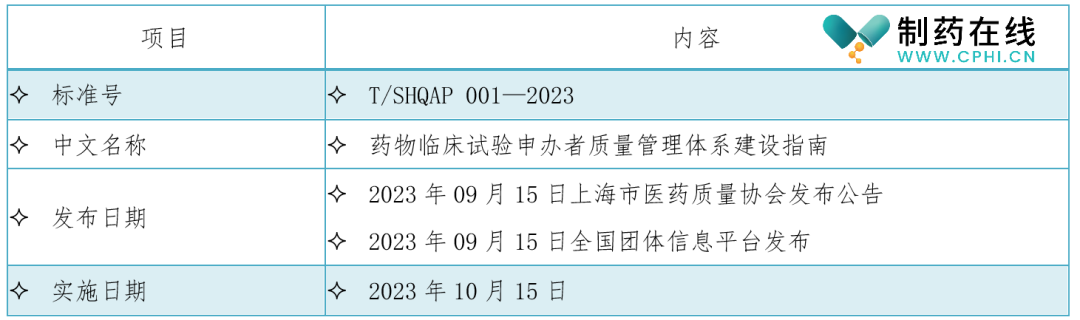
三、《药物临床试验申办者质量管理体系建设指南》起草单位、起草人和主要技术内容
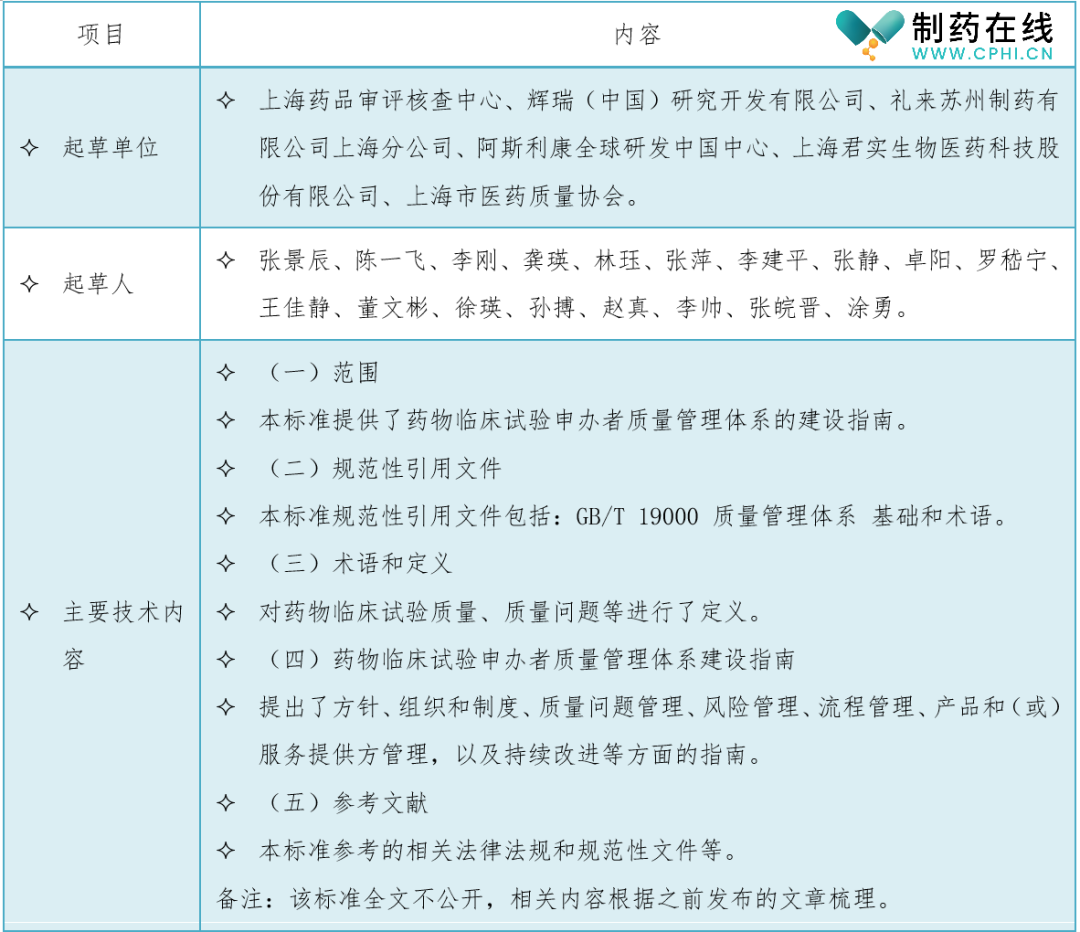
四、药物临床试验申办者搭建质量管理体系关注点

参考文献:
[1] www.ttbz.org.cn、上海医药等








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57