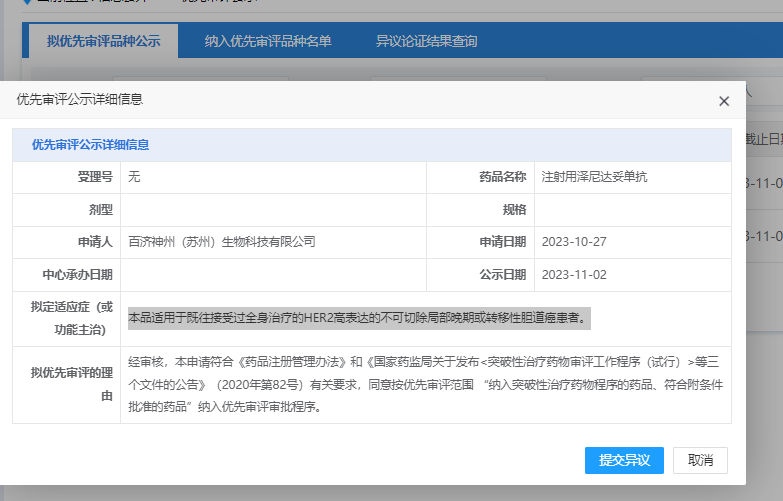
2023年11月2日,CDE官网显示,百济神州靶向HER2的双特异性抗体注射用泽尼达妥单抗(Zanidatamab,ZW25)拟纳入优先审评,适应症为既往接受过全身治疗的HER2高表达的不可切除局部晚期或转移性胆道癌患者。
2020年12月泽尼达妥单抗在美国获突破性疗法认定,2022年2月再次获得CDE纳入突破性疗法。
交易背景
2018年11月,百济神州与Zymeworks达成协议,获得HER2双抗(ZW25)以及HER2双抗ADC(Zanidatamab Zovodotin ZW29),在亚洲(日本除外)、澳大利亚和新西兰的独家开发和商业化权利,同时支付4000万美元的授权首付款、最多3.9亿美元的开发和商业化里程碑付款和潜在未来产品销售的版税。
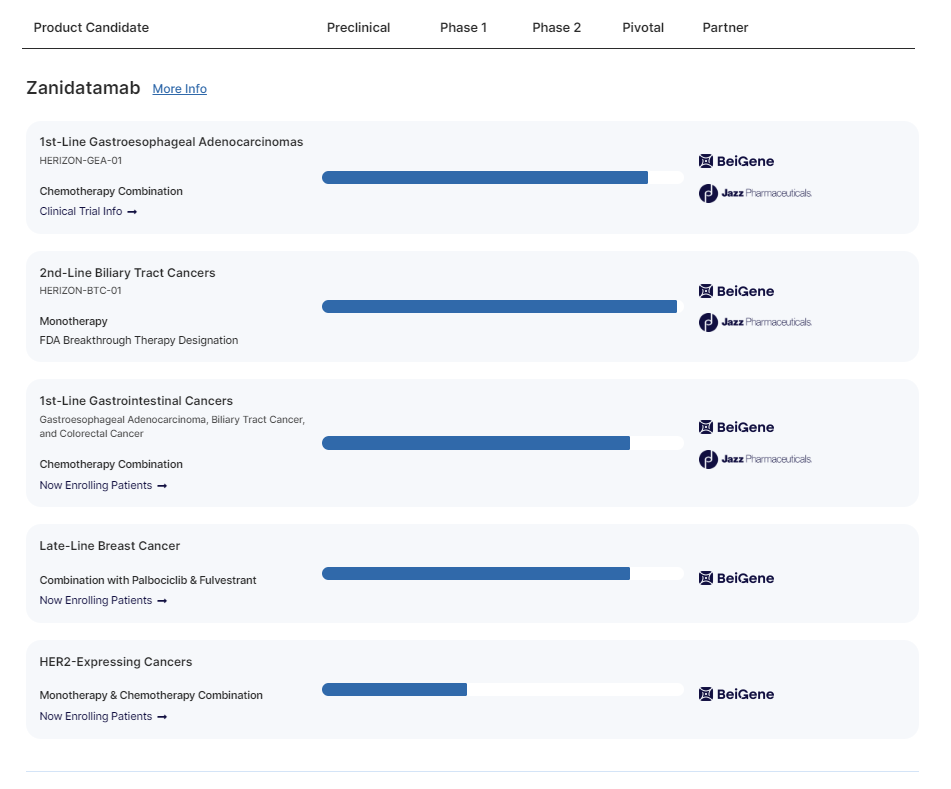
Zanidatamab
Zanidatamab治疗胆道癌临床疗效显著,2023年ASCO会议上报道了泽尼达妥单抗治疗既往经治的HER2扩增性胆道癌的关键性2b期HERIZON-BTC-01研究的结果。入组患者为既往接受过含吉西他滨治疗的HER2扩增的局部晚期不可切除或转移性胆道癌患者,共87例,其中队列1为HER2阳性即IHC 2+/3+患者,队列2为HER2阴性性即IHC 0/1+患者。中位随访时间为12.4个月,中位无进展生存期(PFS)为5.5个月。总体的疾病控制率(DOR)为68.8%。客观缓解率(ORR)为41.3%,中位缓解持续时间(DOR)为12.9个月。研究人员表示,Zanidatamab的ORR与历史数据相比提高了7倍。
目前Zanidatamab已在胆道癌,胃癌,HR2阳性乳腺癌等多个适应症领域开展临床研究。








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57