10月13日,国家药监局发布《关于无参比制剂品种仿制研究的公告(2023年第130号)》(以下简称《公告》)及相关《政策解读》。
《政策解读》中明确:境内外已有公开数据,以及之前公示的《临床价值明确,无法推荐参比制剂的化学药品目录》中所说的“临床价值明确”,不能作为自证临床价值的证据。基于无参比制剂品种的特点,必须坚持高标准、严要求,通过临床试验确证该品种的临床价值。
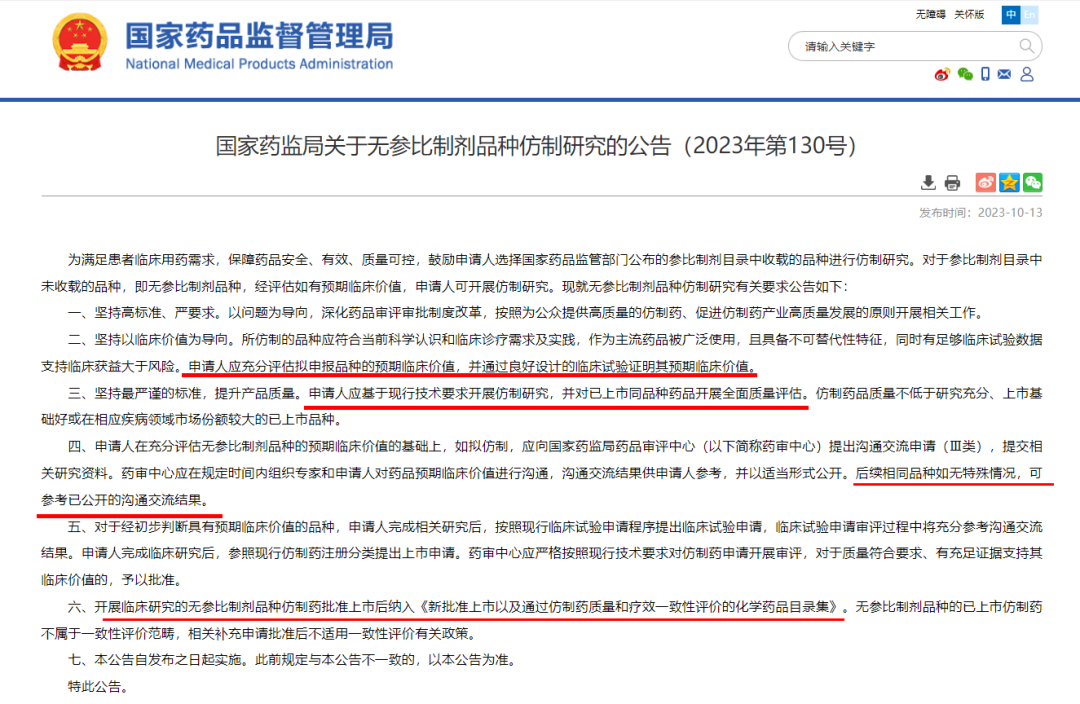
同日,国家药监局药审中心发布《无参比制剂品种开展仿制研究的技术要求和申报资料要求(试行)》、《无参比制剂品种开展仿制研究的沟通交流申请资料要求(试行)》。
以下为两则文件原文:












合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57