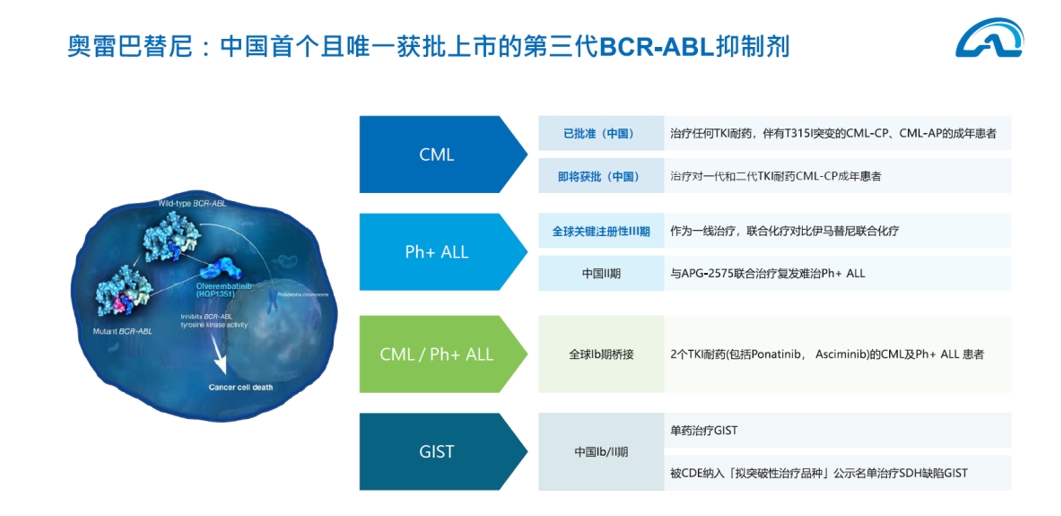
近日,亚盛医药奥雷巴替尼片(商品名:耐立克®)正式获中国国家药品监督管理局(NMPA)批准,用于治疗对一代和二代酪氨酸激酶抑制剂(TKI)耐药和/或不耐受的慢性髓细胞白血病。这是继2021年奥雷巴替尼获批用于伴有T315I突变的耐药CML-CP或加速期(AP)患者后的又一适应症获批。此次新适应症获批奥雷巴替尼覆盖的CML患者群体将扩大3-4倍。
奥雷巴替尼的下一个适应症目标是Ph+ ALL,已开展全球3期注册性临床试验,基于优异的临床数据,有望成为国内首 个用于一线治疗Ph+ ALL的TKI药物。我国每年急淋新患者3.6万人(约占白血病新患者一半),其中Ph+占比30%多,还有20%的Ph+ like患者,这是一个比CML大得多的市场。目前,奥雷巴替尼已获《CSCO恶性血液病诊疗指南》推荐,用于治疗Ph+ALL患者。
此外, BCR-ABL+Bcl-2+化疗联合治疗Ph+ ALL也展现出巨大潜力,今年ASH会议上,奥雷巴替尼联合维奈克拉和低强度化疗治疗初治Ph+ ALL患者的II期临床试验早期结果。疗效数据显示,所有患者均在第一个周期结束时达到完全缓解(CR),没有出现TLS或治疗相关死亡。
亚盛医药同时手握BIC的BCR-ABL抑制剂,以及具BIC潜力的Bcl-2抑制剂APG-2575,联合治疗的潜力更是值得进一步挖掘。今年7月,奥雷巴替尼+化疗联合一线治疗Ph+ ALL的全球关键注册性三期临床已经获批,同时也在开展奥雷巴替尼+APG-2575的中国二期临床。
探索血液肿瘤之外的领域。在2022年美国临床肿瘤学会(ASCO)年会上,亚盛医药公布奥雷巴替尼用于胃肠间质瘤(GIST)患者的临床进展,显示出良好的抗肿瘤活性,临床获益率(CBR)高达83.3%。奥雷巴替尼还具有治疗新型冠状病毒肺炎(COVID-19)尤其是中重度患者的潜力,研究成果已在欧洲分子生物学组织(EMBO)旗下顶级期刊《EMBO Molecular Medicine》上发表。
图片来源:亚盛官网
在推进全球层面的临床开发方面,奥雷巴替尼获加拿大卫生部临床试验许可,将开展治疗耐药CML和费城染色体阳性急性淋巴细胞白血病(Ph+ ALL)患者的Ib期临床研究。目前奥雷巴替尼在美国开展桥接实验,预计今年底披露相关进展。
推进全球层面的市场开发方面,亚盛医药与跨国药物供应商Tanner Pharma携手,启动指定患者药物使用计划(NPP),类似海南的博鳌模式,帮助奥雷巴替尼在尚未获得上市许可的区域为指定患者提供用药机会,计划覆盖130多个国家和地区,惠及全球众多无药可治的慢粒患者。
进入医保后,奥雷巴替尼放量明显。据亚盛医药2022年年报,这一药物在仅获得单一小适应症(T315I突变的耐药CML治疗、国内独家品种)的背景下,自2021年11月上市到2022年年底,累计销售额人民币182.4百万元(含增值税)。而2023年中报显示,奥雷巴替尼被纳入医保后,上半年放量显著,实现销售收入1.08亿元,同比增长37%,其中第二季度销售额同比增长153%,盒数同比增长560%。
奥雷巴替尼的竞争者们
目前,奥雷巴替尼的直接竞争对手主要是武田制药的Ponatinib和诺华的Asciminib。
泊那替尼(ponatinib,英文商品名为Iclusig)为第三款Bcr-Abl激酶抑制剂,该药物最早由美国Ariad Pharmaceuticals进行研发,2014年12月,由日本大冢制药与美国Ariad公司达成合作,并获得该药物在中日韩等亚洲国家商业化的权利。2017年一季度日本武田制药收购Ariad公司并获得这款产品。
今年4月,泊那替尼(ponatinib)被CDE纳入优先审评,拟定适应症包括:1、对既往用药耐药或不耐受的慢性髓性白血病(CML);2、复发或难治性费城染色体阳性急性淋巴细胞白血病(Ph+ALL);3、T315I阳性CML或T315I阳性Ph+ALL,预计最快将于今年获批。
阿西米尼(asciminib) 是诺华开发的一种特异性靶向 BCR-ABL1 蛋白肉豆蔻酰口袋(STAMP)抑制剂,通过结合 ABL 肉豆蔻酰口袋发挥作用。其疗效及安全性均已得到实验验证和认可,于2021年获批在美国上市。此后,又分别于 2022 年 3 月、8 月,在日本、欧盟获批上市,是全球首 个且唯一获批的STAMP抑制剂。
阿西米尼被批准用于治疗慢粒白血病成人患者,适用于以下两种适用症:1、先前接受过两种或多种酪氨酸激酶抑制剂(TKI)治疗、处于慢性期(CP)的费城染色体阳性慢性粒细胞白血病(Ph+CML)。2、具有T315I突变的CP中的Ph+CML。
目前阿西米尼正在国内开展 4 项临床试验,其中,III 期临床试验当前已完成所有受试者的招募工作,该研究旨在对比 Asciminib 和 TKI 疗法用于新确诊的 Ph+ CML-CP 患者的临床疗效。
第三代TKI中的"Best-in-Class"
作为第三代TKI,奥雷巴替尼不仅针对一代和二代TKI有明显的代际优势,甚至相比于其他的三代TKI,奥雷巴替尼也在临床研究中显示出巨大的"Best-in-Class"潜力。
在第三代TKI药物中,奥雷巴替尼是目前数据最好、临床治疗效果最 佳的那一个。在2023年的美国血液年会(ASH)上,亚盛医药公布的多项奥雷巴替尼的研究数据,都以高质量的循证医学证据,完 美支持以上结论。
在一项治疗一代和二代酪氨酸激酶抑制剂(TKI)耐药的CML-CP患者的随机对照注册性II期研究中,与最 佳可用疗法(BAT)的对照组相比,奥雷巴替尼治疗组的无事件生存期(EFS)为21.22个月,而对照组仅仅达到2.86个月,差异非常显著。与对照的BAT治疗组相比,奥雷巴替尼治疗组将事件风险降低了65%。
奥雷巴替尼的海外临床研究显示,针对其他三代TKI药物治疗失败的患者,该品种也展示了显著的临床治疗优势,这几乎可以直接奠定奥雷巴替尼在三代TKI中"Best in Class"的领头羊地位。
在一项针对既往接受过深度治疗/难治性CML和Ph+ ALL患者的临床研究中,一共入组了57例CML-CP患者和19例晚期Ph+ ALL患者, 其中52.6%的患者曾接受过三代TKI药物ponatinib治疗,27.6%的患者曾接受过变构抑制剂asciminib治疗,但是都因为耐药、不耐受或者其他原因而治疗失败,此外还有32%的患者基线合并T315I突变。
临床研究结果表明:在ponatinib治疗失败的患者中,奥雷巴替尼治疗组的CCyR率和MMR率分别为53%和38%;在asciminib治疗失败的患者中,奥雷巴替尼治疗组的CCyR率和MMR率分别为43%和38%。作为三代TKI的奥雷巴替尼,不仅可以作为一代和二代TKI药物耐药后的解决方案,甚至也可以作为其他三代TKI治疗失败的CML或Ph+ ALL患者提供挽救性治疗方案。
同时,奥雷巴替尼的安全性,在三代TKI中也属于佼佼者。另一款三代TKI药物ponatinib引发的包括血栓在内的严重心血管不良事件发生率很高,甚至因为此类不良事件高发,曾经被FDA要求撤市,后因临床需求恢复上市,但被FDA标注"黑框警告"。
结语
奥雷巴替尼经过多项临床验证,已经坐稳BIC地位,CML统治地位稳固,不仅显著优于前两代药物,而且针对其他三代TKI也有明确的优势,同时向ALL、GIST、AML等更多适应症拓展。同时,具备"广谱"抗癌作用的奥雷巴替尼也在不断释放临床潜力,这为该产品未来的市场空间拓展奠定了坚实基础。
参考来源
1. CDE官网
2. 亚盛医药官网
3. Amir M, Javed S. A Review on the Therapeutic Role of TKIs in Case of CML in Combination With Epigenetic Drugs. Front Genet. 2021;12:742802.
4. Qian H, Gang D, He X, Jiang S. A review of the therapeutic role of the new third-generation TKI olverembatinib in chronic myeloid leukemia. Front Oncol. 2022;12:1036437.
5. Qian Jiang, MD, et al. ASH 2023 Oral-869.








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57