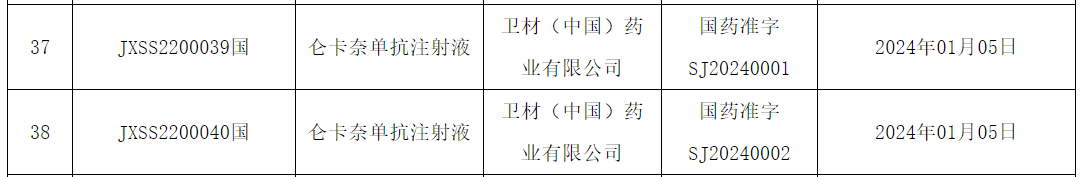
1月9日,NMPA发布药品批准证明文件送达信息,卫材(中国)药业有限公司(以下简称“卫材”)的仑卡奈单抗注射液获批上市。
图片来源:NMPA官网
数十年研发黑洞
曙光已现
目前,阿尔茨海默病众多发病机制学说中,有三种学说已成主流,分别为主Aβ级联学说、Tau蛋白异常磷酸化学说以及胆碱能学说。
仑卡奈单抗注射液(Lecanemab)是一款抗Aβ药物【1】,靶向的是Aβ的聚集形式,包括寡聚体、protofibril、fibril和淀粉样聚集体等。卫材和渤健共同负责该产品的开发和商业化,且卫材拥有最终决策权。
2023年1月6日,基于IIb期概念验证性临床试验结果,FDA在加速审批途径下批准了Lecanemab治疗AD的上市申请。不过,只有在轻度认知障碍或轻度痴呆阶段且在病理学上确认存在Aβ的AD患者中才能进行Lecanemab治疗。
同日,基于验证性III期Clarity AD研究的积极结果(达到了主要终点和所有关键次要终点,且结果具有高度统计学意义),卫材向FDA提交了寻求Lecanemab全面批准的sBLA。
6月9日,药物咨询委员会(PCNS)全票通过了Lecanemab的3期Clarity AD临床试验数据。
7月6日,FDA将Lecanemab的加速批准转为完全批准,Lecanemab成为了20年来首 款获得FDA完全批准的AD新疗法。
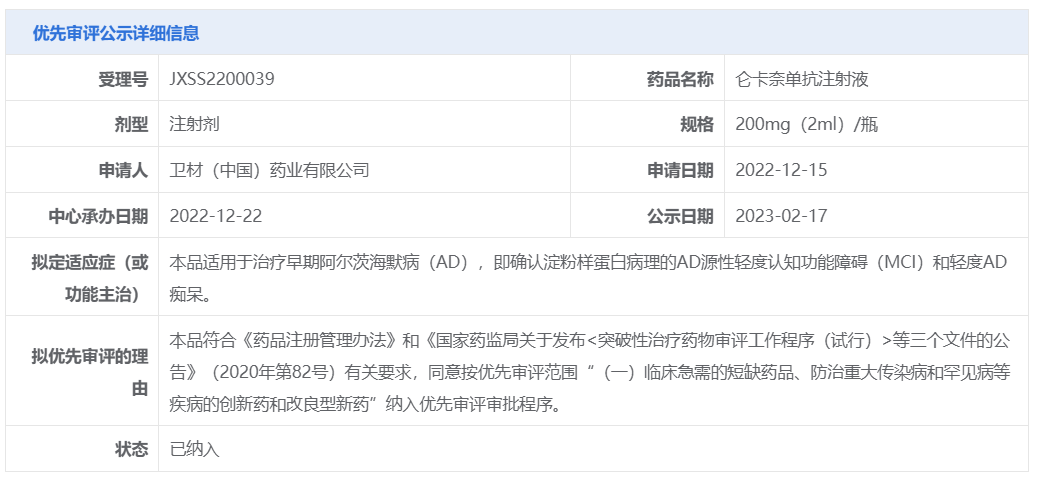
在中国,Lecanemab于2022年12月22日申报上市。2023年2月,Lecanemab被CDE纳入优先审评名单,拟定适应症为治疗早期阿尔茨海默病(AD),即确认淀粉样蛋白病理的AD源性轻度认知功能障碍(MCI)和轻度AD痴呆。
图片来源:CDE官网
结语
2022年,国家卫健委老龄司司长表示,阿尔茨海默病是老年期痴呆最主要的类型,我国60岁及以上老年人中约有1500万痴呆患者,其中1000万是阿尔茨海默病患者。尽管阿尔茨海默病药物开发过程尚且充满曲折,但无数研究者前仆后继,已初见曙光,多发性硬化症(MS)药物甚至GLP-1激动剂等药物也被研究用于治疗阿尔茨海默病……【2】
继获FDA完全批准后,Lecanemab又在中国成功获批上市,成为了阿尔茨海默症治疗领域里程碑式药物之一,今后是否会有更多的突破性药物诞生,可以拭目以待……








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57