WHO已经警告,抗生素耐药问题正日趋严重,而新开发的抗生素不足以应对人类的感染风险。不过,不少公卫专家认为,50年后我们仍会有抗生素问世,只不过与现有的抗生素形式不同。展望未来之前,可以先回顾我们取得的历史成就。
多肽抗生素(AMP,Antimicrobial Peptides),也称为抗菌肽、宿主防御肽,是在各种生物体中发现的天然存在的多肽分子,来源包括人类、动物、植物和微生物。这些肽在先天免疫系统防御微生物感染方面发挥着至关重要的作用。它们具有抗菌特性,可以抑制生长或杀死多种微生物,包括细菌、真菌、病毒,甚至一些寄生虫。
AMP具有广谱活性,可以针对多种病原体,有效对抗各种类型的细菌、真菌和病毒。这种广谱活性在处理耐药微生物时尤其有价值。AMP通常会快速破坏微生物细胞膜的完整性,导致细胞裂解和死亡。这种快速作用模式与许多针对特定细胞过程的传统抗生素形成鲜明对比。除了直接抗菌作用外,一些 AMP还可以调节免疫反应。它们可以将免疫细胞递送到感染部位,增强吞噬作用(免疫细胞吞噬和消灭病原体的过程),甚至具有抗炎特性,包括皮肤感染、呼吸道感染和全身感染的局部治疗。人们还在研究它们在伤口愈合、癌症治疗和其他医疗应用中的潜力。
由于AMP针对微生物细胞膜的物理结构而不是特定的细胞过程,因此它们导致微生物产生耐药性的可能性较低。这使它们成为对抗耐药菌株的潜在候选者。
AMP的例子包括防御素、抗菌肽等。这些肽是抵御感染的第一道防线的一部分,由多种细胞产生,包括白细胞和皮肤、粘膜和其他组织中的上皮细胞。研究人员正在积极研究抗菌肽,以更好地了解其作用机制,优化其在临床环境中的使用,开发新的治疗策略来对抗感染和抗生素耐药病原体。
1
粘菌素,第一个药用多肽抗生素
1947年,第一个抗生素多肽多粘菌素(polymyxins)家族被发现,由多粘类芽孢杆菌 (Paenibacillus polymyxa) 产生,[1] 包含多粘菌素B1, B2, E等成员(图1)。
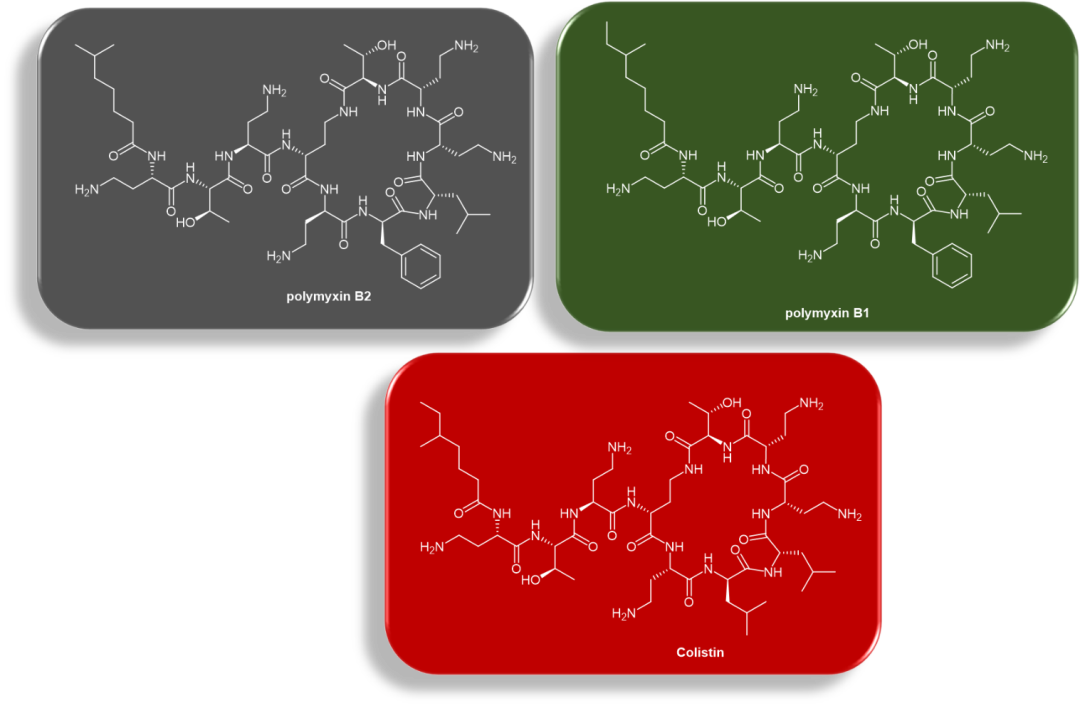
图1. 多肽抗生素多粘菌素:多粘菌素B1,多粘菌素 B2,多粘菌素E(colistin)化学结构。
多粘菌素首次临床应用是在1959年,粘菌素(Colistin, 粘菌素中文名与其家族多粘菌素容易混淆。粘菌素也被称为多粘菌素polymyxin E)。Colistin(polymyxin E)是一种抗生素药物,用作治疗包括肺炎在内的多重耐药性革兰氏阴性菌感染的最后手段。粘菌素于1949年在日本首次由Y. Koyama从一瓶发酵的多粘芽孢杆菌中分离出来, 并于1959年用于临床,商品名为Cortisporin?。
多粘菌素钠是一种毒性较低的前药,于1959年可用于注射。在1980年代,由于肾毒性和神经毒性,多粘菌素的使用被广泛停止。随着多重耐药细菌在1990年代变得更加普遍,粘菌素开始重新审视作为一种紧急解决方案,尽管它具有毒性。[2]
粘菌素Colistin是一种表面活性剂,可渗透并破坏细菌细胞膜。粘菌素是聚阳离子的(含有多个2,4-二氨基丁酸Dab残基),同时具有疏水性和亲脂性部分。它与细菌细胞质膜相互作用,改变其渗透性。这种作用是杀菌的。还有证据表明多粘菌素进入细胞并沉淀细胞质成分,主要是核糖体。
2
多肽抗生素(AMPs, Anti-Microbial Peptides)
常见抗生素,根据其药理学和化学结构,可以大致分为:青霉素类(Penicillins)、头孢菌素类(Cephalosporins)、四环素类(Tetracyclines)、氨基糖苷类(Aminoglycosides)、大环内酯类(Macrolides)、克林霉素类(Clindamycin)、磺胺类(Sulfonamides)、甲氧苄啶(trimethoprim)、甲硝唑(Metronidazole)、替硝唑(tinidazole)、喹诺酮类(Quinolones)、呋喃妥因(Nitrofurantoin)和多肽类。
多肽类抗生素(AMP,或称抗菌肽)是一类化学性质不同的抗感染和抗肿瘤抗生素。属于AMP的多肽抗生素包括放线菌素-D(actinomycin D/Cosmegen?), 杆菌肽(bacitracin /Bacitracin?),粘菌素(colistin /Cortisporin?),以及多粘菌素 B(polymyxin B)(图1,2)。放线菌素-D 已用于癌症化学疗法。大多数其他多肽抗生素对于全身给药而言毒性太大,但可以作为浅切口和擦伤的防腐剂安全地局部给药于皮肤。
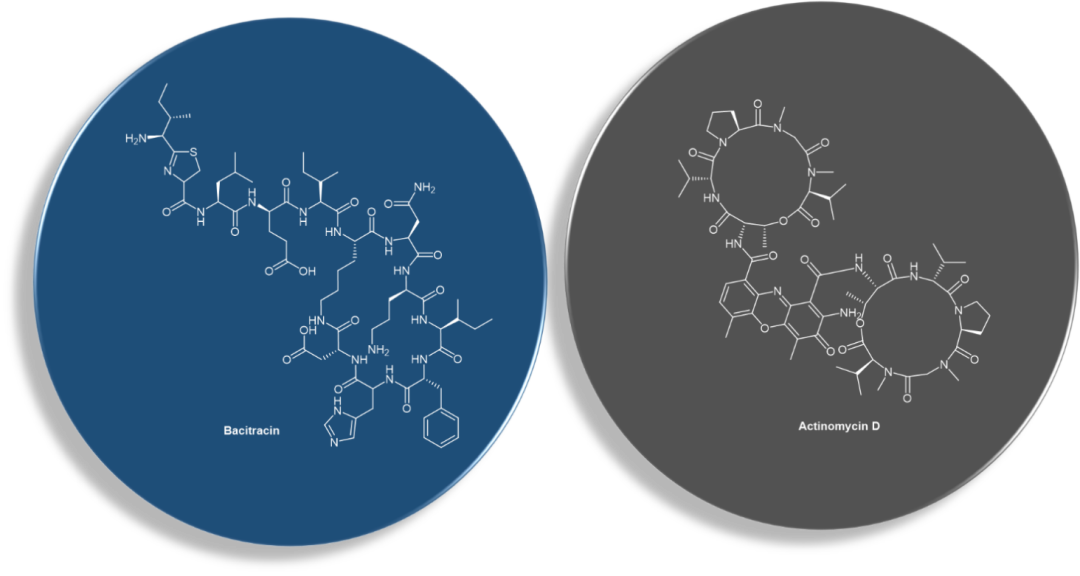
图2. 多肽抗生素放线菌素-D (actinomycin D) 和杆菌肽 (bacitracin) 化学结构。
3
多肽抗生素抗菌机理
抗生素的抗菌机理大致可以分为三大类:抑制细胞壁合成、增加细胞膜通透性、干扰蛋白质合成、核酸代谢和其他代谢过程(如叶酸合成)(图3)。
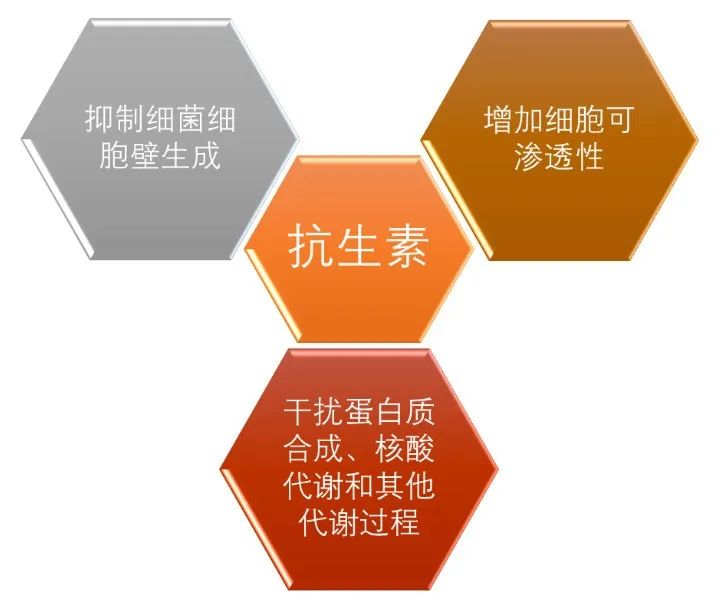
图3. 常见的抗生素抗菌机制
多肽抗生素AMPs主要通过两种不同的机制发挥其抗菌作用: 1) 靶向膜的 AMP 破坏细菌细胞膜结构的完整性;2)非膜靶向的 AMP则主要通过抑制核酸、酶和其他功能蛋白的合成(图4)。这两种机制中,前者破坏细菌膜的稳定性,破坏细胞膜;后者能够跨膜转移而不破坏细胞膜,但会破坏正常细胞功能。
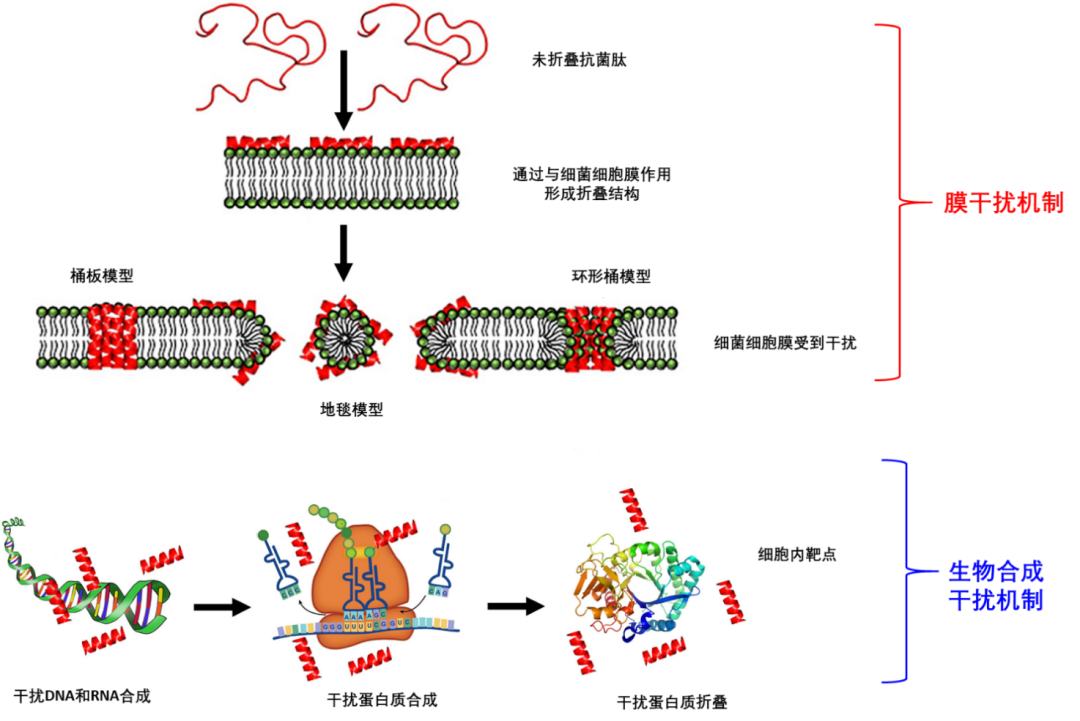
图4. 多肽抗生素AMPs作用机制。(图片来源:Journal of Applied Microbiology)
1
膜破坏机制
膜活性多肽抗生素可以通过受体介导或非受体介导的相互作用与微生物细胞表面相互作用,甚至有些高效的AMP无需任何特定受体即可与细胞表面上的一般目标产生初始相互作用。AMP的物理化学特性,例如净电荷、疏水性、两亲性、膜曲率和自聚集倾向,在导致膜完整性破坏的肽-膜相互作用的管理中具有重要作用。[3]这种抑制导致细胞包膜的渗透性增加、细胞内容物渗漏,最终导致细胞死亡。
膜活性AMP的作用机制主要依靠阳离子和疏水作用。尤其是带正电荷残基(例如精氨酸和赖氨酸等)的AMP与带负电荷的细菌细胞表面的静电作用,为AMP与膜结合提供了重要的驱动力。[4] 细菌细胞膜的特点是带有丰富的负电荷,例如阴离子脂质含量较高,包括磷脂磷脂酰甘油(PG)、心磷脂和磷脂酰丝氨酸,这些负电荷与AMP上的正电荷(主要是铵离子)产生强大的经典引力,而动物细胞膜则具有两性离子磷脂,例如磷脂酰胆碱(PC)和鞘磷脂(因此较小受到AMPs的破坏与干扰)。
此外,磷壁酸、脂磷壁酸和脂多糖(LPS)是其他带负电荷的细菌细胞表面成分,也被认为是AMP的潜在靶标。因此,与AMP和细菌膜之间发生的相互作用相比,AMP和哺乳动物细胞膜之间的静电相互作用相对较弱。此外,哺乳动物细胞膜含有胆固醇,可增强细胞膜的稳定性并阻止AMP的插入,[5] 为AMPs使用的安全性提供了保障。
除了丰富的负电荷之外,疏水性本身也是肽的主要特征(主链与疏水性的侧链),控制疏水残基与膜脂脂肪酰基链的相互作用,从而控制肽的跨膜片段插入,以及分配到双层的疏水核心中,也是多肽抗生素干扰破坏细菌细胞膜的重要机制之一。[6]但并非疏水性越高越好,一般来说,中等疏水性肽具有最 佳活性,而高度疏水性肽表现出强烈的溶血活性和降低的抗菌活性。[7] 除此之外,多肽的两亲性 (同时具备亲水和亲脂的结构) 有助于AMP的α-螺旋二级结构与膜的结合亲和力。两亲性 AMP的疏水性残基与脂质双层结合,而它们的亲水性残基与磷脂基团相互作用。[8]
随着与膜结合的AMP浓度增加,它们会产生肽-肽或脂质-肽复合物。当AMP在膜中的积累达到临界聚集浓度时,AMP会渗透到双层的疏水核心并在细胞质膜中形成跨膜孔(图4)。[9]
● 在桶板模型中,AMP 分子通过多肽亲水区域的相互作用和自组装吸附在膜表面。当横向积累的肽单体在膜上达到一定密度时,肽块垂直旋转到质膜。最后,肽块位于双层的疏水区域,并构建一个亲水表面向内的通道。[10]
● 环形桶模型中,肽垂直插入双层中,类似于桶壁模型,但形成肽-脂质复合物,而不是肽-肽相互作用。肽的这种构象促进细菌细胞膜的局部弯曲,部分被肽包围,部分被磷脂头基团包围,导致形成“环形孔”。[11]
● 在地毯模型中,由于带正电荷的阳离子肽和带负电荷的极性磷脂头之间的相互作用,AMPs平行于膜表面结合。当肽达到临界浓度后,它们重新定向到膜内部并形成具有疏水核心的胶束,导致膜崩解。[11]
2
非膜活性机制
虽然AMP的杀菌作用最初是由膜活性机制主导的,但随后人们了解到许多AMP靶向必需的细胞成分和细胞功能,导致细菌死亡的机制。这些AMP首先在不干扰细胞膜的情况下转移到细胞内,然后通过与细胞内靶标相互作用来阻止关键的细胞过程。例如抑制蛋白质和核酸的合成,以及酶和蛋白质的降解。[12] 更具体地说,多肽抗生素可以阻止细胞质中合成的肽聚糖前体转运到在细菌细胞壁,肽聚糖是细菌细胞壁形成的关键因素。这种同一抑制细菌细胞壁生长,从而抑制细菌复制的多肽抗生素,是开发新抗菌药物的主要力量。
4
多肽抗生素的耐药性问题
许多传染性病原体,尤其是革兰氏阴性菌,已经对常规抗生素产生了耐药性。在极少数情况下,这些病原体对所有市售抗生素都有耐药性。这种耐药现象不仅限于细菌,还延伸到致病真菌、病毒和寄生虫。同其它类型的抗生素一样,AMPs也面临着耐药性的挑战。耐药性是细菌响应这些药物的使用而发生突变的结果,例如通过阻断作用位点产生耐药性,因此它不能对抗细菌的功能。这种耐药性发生的方法可能解释了多肽抗生素无法作用于革兰氏阴性菌,即具有薄肽聚糖层的细菌,其中生长培养基的变化导致细菌外膜发生变化而使得AMPs无法作用。[13]
相对来说,多肽类抗生素较少出现耐药性,例如杆菌肽。在大多数情况下,多肽克服耐药性的能力源于它们抑制细胞壁合成的作用机制,从而在耐药性能够形成之前阻止细菌细胞的增殖。这些新型抗生素可以替代传统抗生素,细菌衍生的多肽抗生素是人类对抗细菌耐药性的重大宝库。特别是从芽孢杆菌(Bacillus species)中分离出的多肽抗生素,有可能成为克服当前抗生素缺点的最有前途的候选者。[14]
各种芽孢杆菌菌株的多肽抗生素已被广泛表征,并且已发现其中许多肽适用于各种应用。[15] 芽孢杆菌属产生大量具有不同基本化学结构的肽类抗生素,[16] 包括细菌素、糖肽、脂肽和环肽。[17] 因此,芽孢杆菌属的多肽抗生素可能是传统抗生素的有前途的替代品,可有效治疗单药和多药耐药的传染性病原体。[18]
5
上市多肽抗生素
目前,乳链菌肽nisin、短杆菌肽gramicidin、多粘菌素polymyxins、达托霉素daptomycin和蜂毒肽melittin因其抗菌效力而在临床上用作抗生素。
● Nisin乳链菌肽
乳链菌肽Nisin是FDA批准的GRAS(generally regarded as safe通常被认为是安全的)肽,具有公认的临床应用潜力。近二十年来,乳链菌肽的应用已扩展到生物医学领域。研究报道,乳链菌肽可以阻止耐药菌株的生长,如耐甲氧西林金黄色葡萄球菌、肺炎链球菌、肠球菌和艰难梭菌。现在已证明乳链菌肽对革兰氏阳性和革兰氏阴性疾病相关病原体具有抗菌活性。据报道,乳链菌肽具有抗生物膜特性,可以与常规治疗药物协同作用。此外,与宿主防御肽一样,乳链菌肽可激活适应性免疫反应并具有免疫调节作用。越来越多的证据表明乳链菌肽可以影响肿瘤的生长并对癌细胞表现出选择性细胞毒性。[19]
● Gramicidin D短杆菌肽D
Gramicidin D(短杆菌肽D)是一种杀菌抗生素,用于治疗皮肤病和眼科感染。商品名包括Sofracort, Soframycin, Triple Antibiotic, Viaderm Kc等。Gramicidin D是三种抗生素化合物的异质混合物,Gramcidin A、B 和 C,分别占80%、6% 和14%,所有这些都从土壤细菌物种短芽孢杆菌中获得,统称为Gramcidin D。短杆菌肽是具有交替D和L氨基酸的15个残基肽,它们在细胞脂质双层的疏水内部组装形成 β-螺旋。
Gramicidin D对大多数革兰氏阳性菌和一些革兰氏阴性生物具有活性,主要用作局部抗生素,也存在于Polysporin滴眼液中。由于该药物具有高度溶血性,因此不能内服,因此只能以洗剂或软膏的形式在皮肤上使用。它主要用于治疗感染的表面伤口,以及眼、鼻和喉咙感染。它通常与其他两种抗生素(neomycin和多粘菌素B)一起作为眼药水给药。
短杆菌肽 D 结合并插入细菌膜(强烈偏好革兰氏阳性细胞膜)。这导致膜破裂和透化(它充当通道)。这导致 (i) 细胞内溶质(例如 K+ 和氨基酸)的损失;(ii) 跨膜电位的耗散;(iii) 呼吸抑制;(iv) ATP 池减少;(v) 抑制 DNA、RNA 和蛋白质合成,从而导致细胞死亡。
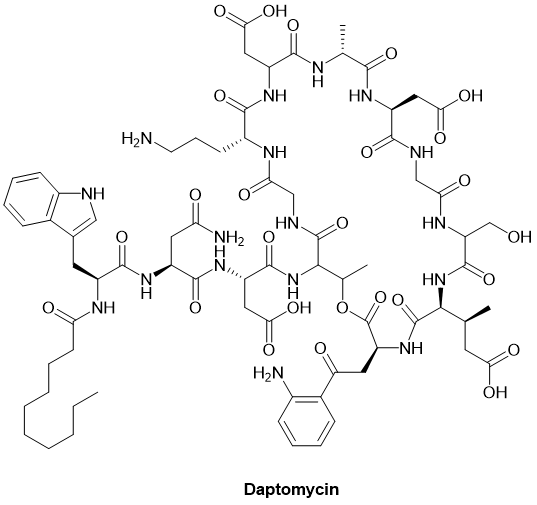
● Daptomycin达托霉素
Daptomycin(达托霉素)是一种环状脂肽类抗生素,用于治疗由敏感的革兰氏阳性菌引起的复杂皮肤和皮肤结构感染以及金黄色葡萄球菌引起的菌血症。以Cubicin, Dapzura等商品名销售。达托霉素适用于治疗1岁及以上患者的复杂皮肤和皮肤结构感染(cSSSI)。它还适用于治疗一岁及以上患者的金黄色葡萄球菌血流感染(菌血症),包括患有右侧感染性心内膜炎的成年患者。[20]
● Colistin(前文介绍)
● Vancomycin万古霉素
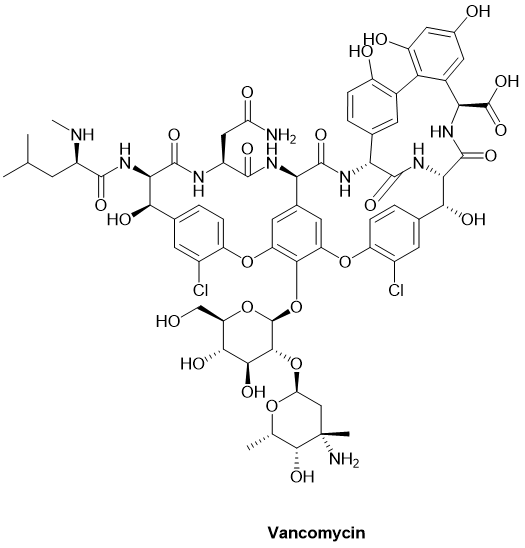
Vancomycin(万古霉素)是一种糖肽类抗生素,用于治疗严重但易感的细菌感染,例如MRSA(耐甲氧西林金黄色葡萄球菌)感染,商品名包括Firvanq, Vancocin等。万古霉素是一种支链三环糖基化非核糖体肽,通常被保留为“最后的药物”,仅在其他抗生素治疗失败后才使用。
万古霉素的杀菌作用主要来自抑制细胞壁生物合成。万古霉素可防止 N-乙酰胞壁酸(NAM)和 N-乙酰葡糖胺(NAG)肽亚基掺入肽聚糖基质中,而肽聚糖基质是革兰氏阳性细胞壁的主要结构成分。万古霉素与NAM/NAG肽的末端 D-丙氨酰-D-丙氨酸部分形成氢键,阻止NAM/NAG肽亚基掺入肽聚糖基质中。此外,万古霉素改变细菌细胞膜的通透性和RNA合成。万古霉素与其他抗生素之间无交叉耐药性。
● Oritavancin奥利万星
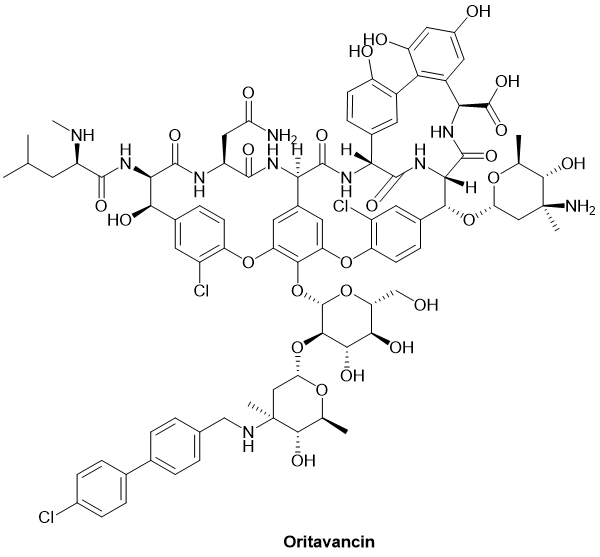
奥利万星(Oritavancin)是一种抗菌肽,用于治疗由敏感的革兰氏阳性菌引起的急性细菌性皮肤和皮肤结构感染。商品名包括Kimyrsa, Orbactiv等。奥利万星适用于治疗患有急性细菌性皮肤和皮肤结构(包括皮下)感染的成年患者。
奥利万星通过三种不同的机制对抗易感的革兰氏阳性生物。首先,它与肽聚糖前体结合,抑制转糖基作用(聚合)。这个过程通常发生在细菌的细胞壁合成过程中。其次,奥利万星通过与细胞壁五甘氨酰肽桥接片段结合,抑制细菌细胞壁生物合成过程中的交联。最后,这种药物还通过破坏细菌细胞膜发挥作用,干扰其完整性,最终通过各种机制导致细胞死亡。[21]
● Dalbavancin达巴万星
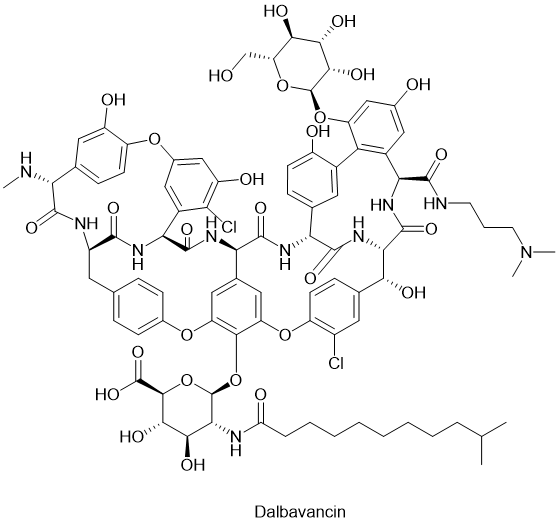
Dalbavancin(达巴万星)是一种抗菌肽药物,用于治疗由敏感的革兰氏阳性菌菌株引起的急性细菌性皮肤和皮肤结构感染(ABSSSI)。商品名为Dalvance。达巴万星具有类似于万古霉素的作用谱和作用机制,万古霉素是一种天然形成的糖肽类抗菌剂。
达巴万星的杀菌作用主要来自细胞壁生物合成的抑制。此外,达巴万星还能改变细菌细胞膜的通透性和RNA合成。
● Telavancin特拉万星
Telavancin(特拉万星)是一种抗菌肽,用于治疗复杂的皮肤和皮肤结构感染,以及各种类型的医院获得性细菌性肺炎。商品名为Vibativ。特拉万星是一种杀菌脂糖肽,对多种革兰氏阳性菌具有活性。Telavancin通过与D-Ala-D-Ala 结合防止 N-乙酰胞壁酸(NAM)和N-乙酰葡糖胺(NAG)的聚合,以及肽聚糖的交联。细菌细胞壁合成因此受到抑制。此外,由于亲脂性侧链部分,特拉万星破坏膜电位和细胞通透性。这种额外的杀菌机制使特拉万星有别于万古霉素。








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57