12月29日,博雅生物发布公告称,公司收到国家药品监督管理局于2021年12月28日签发的《药物临床试验批准通知书》(通知书编号:2021LP02122),公司申报的静注人免疫球蛋白(10%)(受理号:CXSL2101366)临床试验申请已获批准。

本次获得的《药物临床试验批准通知书》的产品为静注人免疫球蛋白(10%),公司已有5%浓度的多种规格静注人免疫球蛋白上市。
静注人免疫球蛋白(10%)适用治疗原发性免疫球蛋白G缺乏症,如X联锁低免疫球蛋白G血症,常见变异性免疫缺陷病,免疫球蛋白G亚类缺陷病等;治疗继发性免疫球蛋白G缺陷病,如重症感染,新生儿败血症,婴幼儿毛细支气管炎等;治疗自身免疫性疾病,如原发性血小板减少性紫癜、川崎病等。
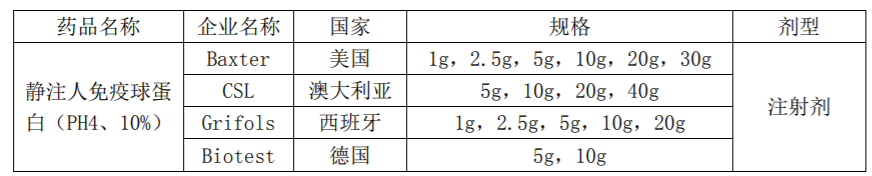
目前,静注人免疫球蛋白(10%)尚无国内产品上市。国际市场主要厂家及规格情况如下:
截至目前,公司静注人免疫球蛋白(10%)累计研发投入1,951.47万元。








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57