上海复星医药(集团)股份有限公司(以下简称“本公司”)控股子公司桂林南药股份有限公司(以下简称“桂林南药”)于近日收到美国 FDA(即美国食品药品监督管理局,下同)出具的现场检查报告(即 EIR),现就相关情况公告如下:
一、本次检查情况
企业名称:桂林南药
生产地址:桂林市七里店路 43 号
检查类别:批准前生产现场检查(Pre-Approval Inspection)和常规监督性检
查(Surveillance Inspection)
涉及产品:盐酸舍曲林片、复方磺胺甲噁唑片、原料药(布美他尼)
检查范围:涉及口服制剂生产制造中心的 OSD-I 车间、原料药生产制造中心的
API-II 车间、仓库、实验室等
检查结论:通过检查
二、本次检查所涉生产设施情况
本次检查所涉生产设施为现有口服制剂生产制造中心的 OSD-I 车间和原料药生产制造中心的 API-II 车间;其中,OSD-I 车间系首次通过美国 FDA 现场检查。本集团(即本公司及控股子公司单位,下同)针对本次检查累计投入约为人民币 345 万元(未经审计)。
首次通过美国 FDA 现场检查的 OSD-I 车间具体情况如下:
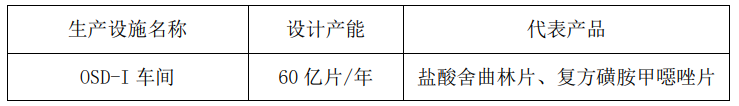
三、OSD-I 生产车间主要产品的市场情况
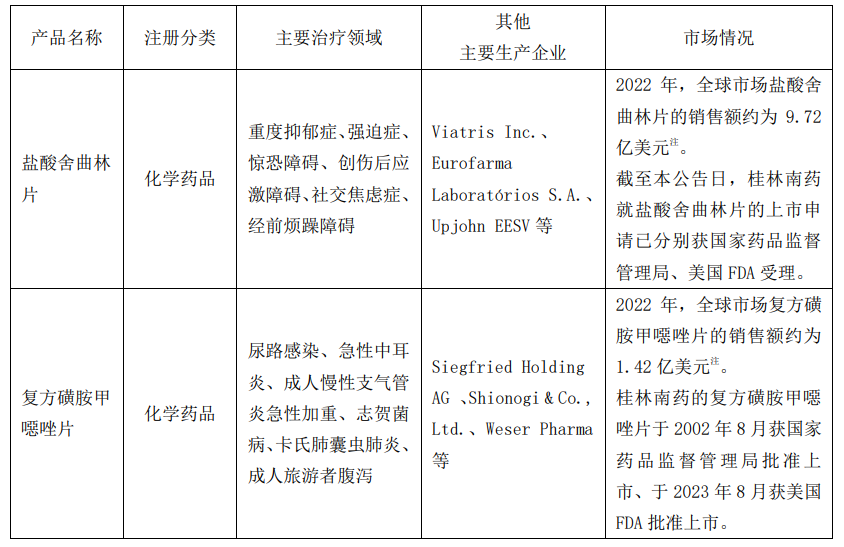
注:全球市场数据来源 IQVIA MIDASTM(由 IQVIA 提供,IQVIA 是医药健康产业专业信息和战略咨询服务提
供商)。
四、对上市公司的影响及风险提示
本次为桂林南药的 OSD-I 车间首次通过美国 FDA 现场检查、API-II 车间通过美国 FDA 常规监督性检查。本次通过现场检查后,桂林南药盐酸舍曲林片、复方磺胺甲噁唑片的相关生产设施已符合美国 FDA 的 cGMP 标准。本次通过美国 FDA 现场检查会对本集团现阶段业绩产生重大影响。
由于医药产品的行业特点,各类产品上市后的具体销售情况可能受到(包括但不限于)用药需求、竞争环境、销售渠道等因素影响,具有较大不确定性。敬请广大投资者注意投资风险。








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57