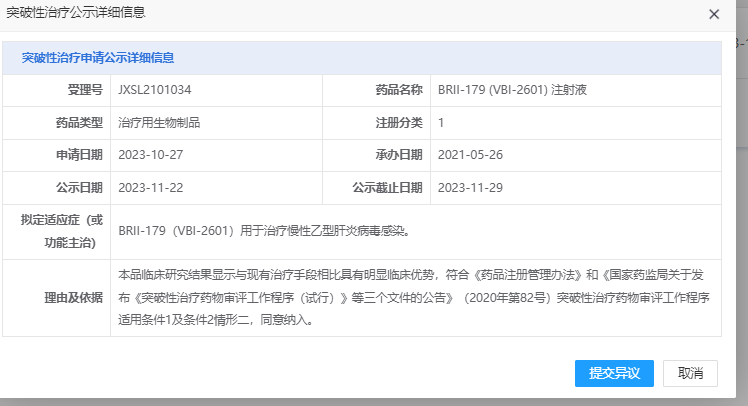
11月22日,国家药监局(CDE)官网显示,腾盛博药1类新药BRII-179(VBI-2601)注射液拟纳入突破性治疗,BRII-179是一款首 创的重组蛋白HBV免疫治疗候选药物。
2018年腾盛博药从VBI Vaccines引进BRII-179,获得了在大中华区(包括中国大陆、中国香港、中国澳门和中国台湾地区)的商业化权益。自2023年7月起,该公司还将BRII-179的独家许可扩展至全球。
乙肝表面抗原又可以被划分为S区、前S1(PreS1)区、前S2(PreS2)区,大部分隐匿性乙肝病毒感染患者可被检测出感染的乙型肝炎病毒有S区基因突变或前S区缺失等。
BRII-179是一种包含3种HBV表面抗原(PreS1、PreS2 和 S)组成的治疗性疫苗,作用机制为靶向增强B细胞和T细胞特异性免疫,从而实现慢性HBV感染功能性治愈的目标,与VBI的Sci-B-Vac?疫苗相同的重组蛋白质成分,而该疫苗是唯一已获批准且目前于市场在售的第三代预防性疫苗。
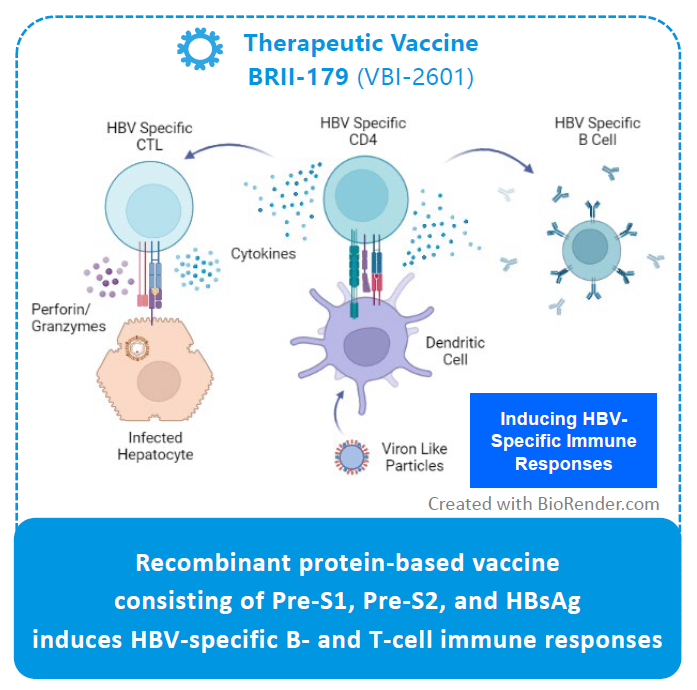
2023年11月美国肝病研究协会年会(AASLD)上发布最新数据显示:
在现有PEG-IFNα基础上联合BRII-179治疗,总体安全且耐受性良好,其不良事件与既往报道的PEG-IFNα治疗和BRII-179的不良事件相似。
在第36周(治疗结束后 [EOT] 12周),与安慰剂+PEG-IFNα组相比,BRII-179+PEG-IFNα组的HBsAg清除率更高(全分析集 [FAS]:24.6% vs. 14.0%,符合方案集 [PPS]:31.8% vs. 14.9%)。在第24周(EOT)已观察到该HBsAg清除率方面的差异,这种差异一直维持到第36周。临床研究还发现,在第24周(EOT),联合给药组的HBsAg血清学转换率显著高于安慰剂+PEG-IFNα组(FAS:15.8% vs. 1.8%,p=0.0163;PPS:19.6% vs. 2.0%,p=0.0058)。
联合BRII-179可诱导针对HBsAg的稳健的、功能性的抗体应答。BRII-179+PEG-IFNα联合给药组的受试者在第24周和第36周的乙型肝炎表面抗体(HBsAb)应答率显著高于安慰剂+PEG-IFNα组,具体结果如下:
第24周
FAS:38.6% vs. 14.0%,p=0.0052;
PPS:39.1% vs. 13.7%,p=0.0054。
第36周
FAS:33.3% vs. 12.3%,p=0.0131;
PPS:34.1% vs. 10.6%,p=0.0105。
在第24周和第36周,HBsAb滴度与HBsAg清除显著相关,HBsAg反弹的5例患者中有4例检测不到抗体应答。








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57