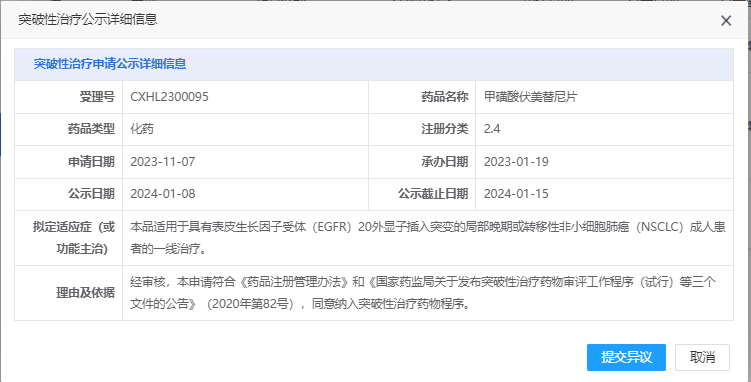
近日,国家药品监督管理局药品审评中心(CDE)官网公示,艾力斯自主开发的重磅三代EGFR抑制剂甲磺酸伏美替尼片再次被拟纳入突破性治疗品种,适应症:具有表皮生长因子受体(EGFR)20外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
2023年10月30日,美国FDA授予伏美替尼用于EGFR 20号外显子插入突变的晚期或转移性非小细胞肺癌一线治疗的突破性疗法认定。
根据药渡数据库检索可知甲磺酸伏美替尼片(商品名:艾弗沙)最早于2021年3月在国内获批上市,在中国已获得针对EGFR敏感突变和T790M突变的适应症,并都已纳入中国国家医疗保险目录。2023年前三季度伏美替尼销售额13.48亿元人民币,比上年同期增加8.3亿,同比增长160%,预计全年超过20亿元人民币。
2023年世界肺癌大会(WCLC)上公布了伏美替尼治疗EGFR 20号外显子插入突变的非小细胞肺癌FAVOUR研究最新临床数据。
FAVOUR研究是一项全国多中心、随机开放的Ib期临床研究,纳入EGFR 20外显子插入突变的局部晚期或转移性非小细胞肺癌患者,随机接受伏美替尼不同剂量组治疗。截至2023年6月15日,FAVOUR研究累计入组为86例进行安全分析,且累计80例可评估的患者进行疗效分析。
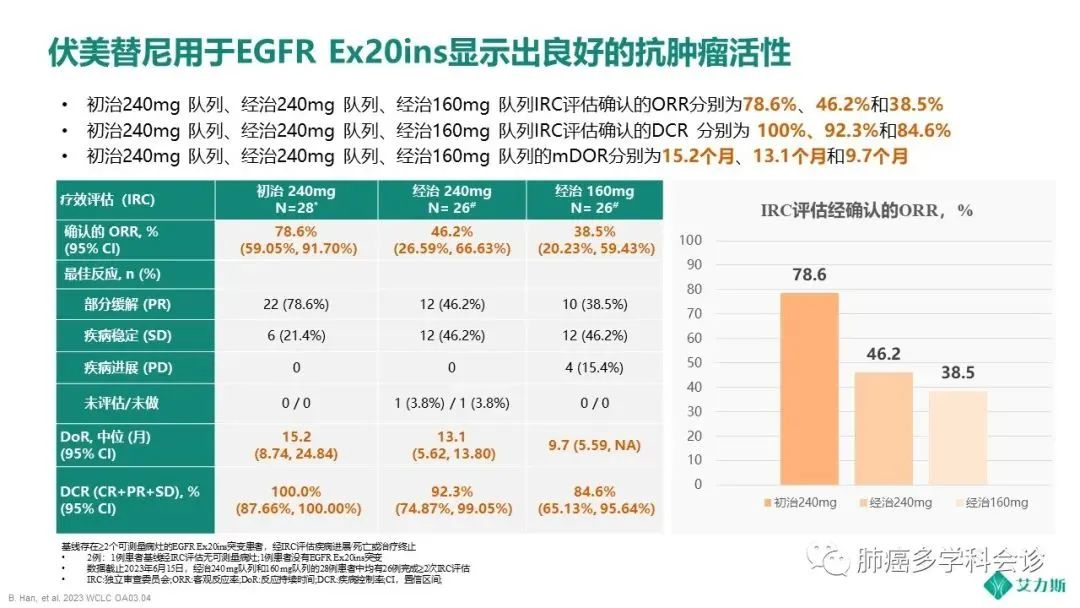
IRC的结果显示,初治240mg组、经治240mg组、经治160mg组的确证ORR分别为78.6%、46.2%、38.5%;中位DoR则为15.2个月、13.1个月、9.7个月。
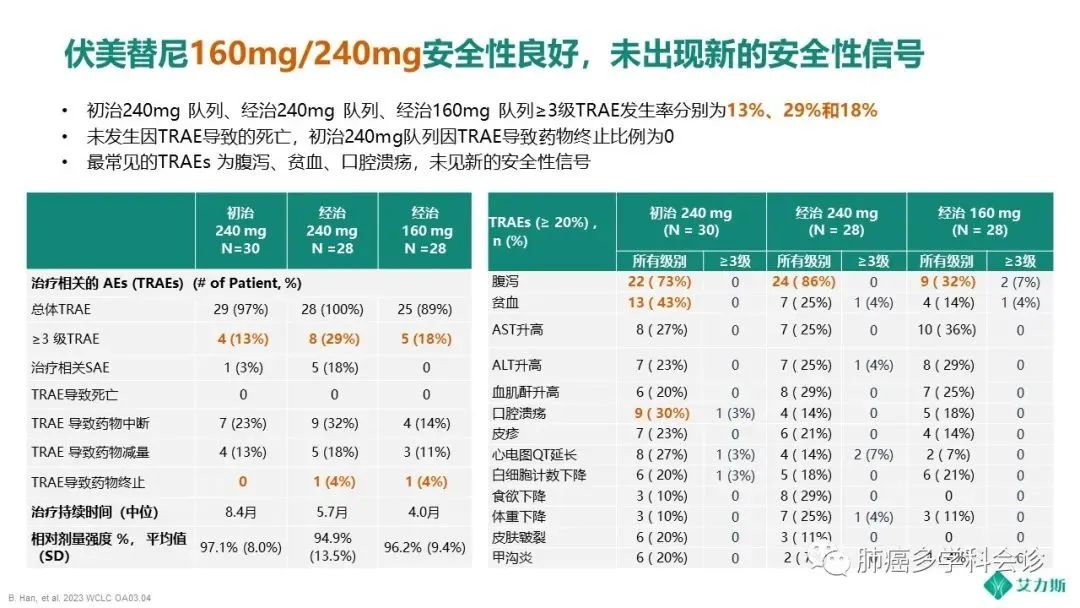
在初治240mg、经治240mg和经治160mg组的队列中,分别有0%、4%和4%的患者因TRAE停止治疗。3个队列中3级TRAE发生率分别为13%,29%和18%。160mg和240mg队列组的安全性与上市获批的80mg剂量下的安全性一致。最常见的药物相关不良事件包括腹泻、 贫血和肝酶升高,未见新的安全信号。








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57