1月29日,CDE 公示第 26 批拟纳入优先审评名单。继南京传奇后,又有 3 个CAR-T产品驶入优先审批快车道,但 2018 年新申报的 2 个产品暂时还没有进入。
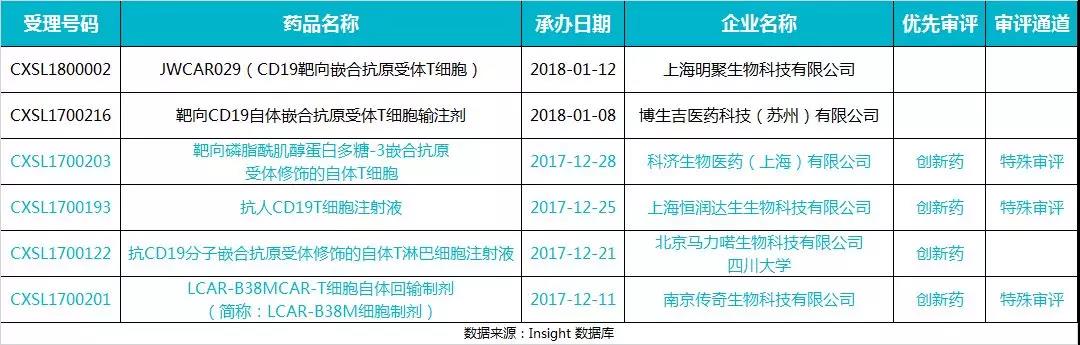
这是 2017 年 12 月 28 日,旧版废止,新版优先审评颁布后首批公示的优先审评名单。
全面查看 26 批优先审评名单后,我们也发现总局在实际操作中,并非所有看上去符合文件 / 法规要求的注册申请,都能被纳入优先审评审批。
总的来看,总局在选择优先审评品种时,有以下的 4 个「偏好」,企业可以对号入座!
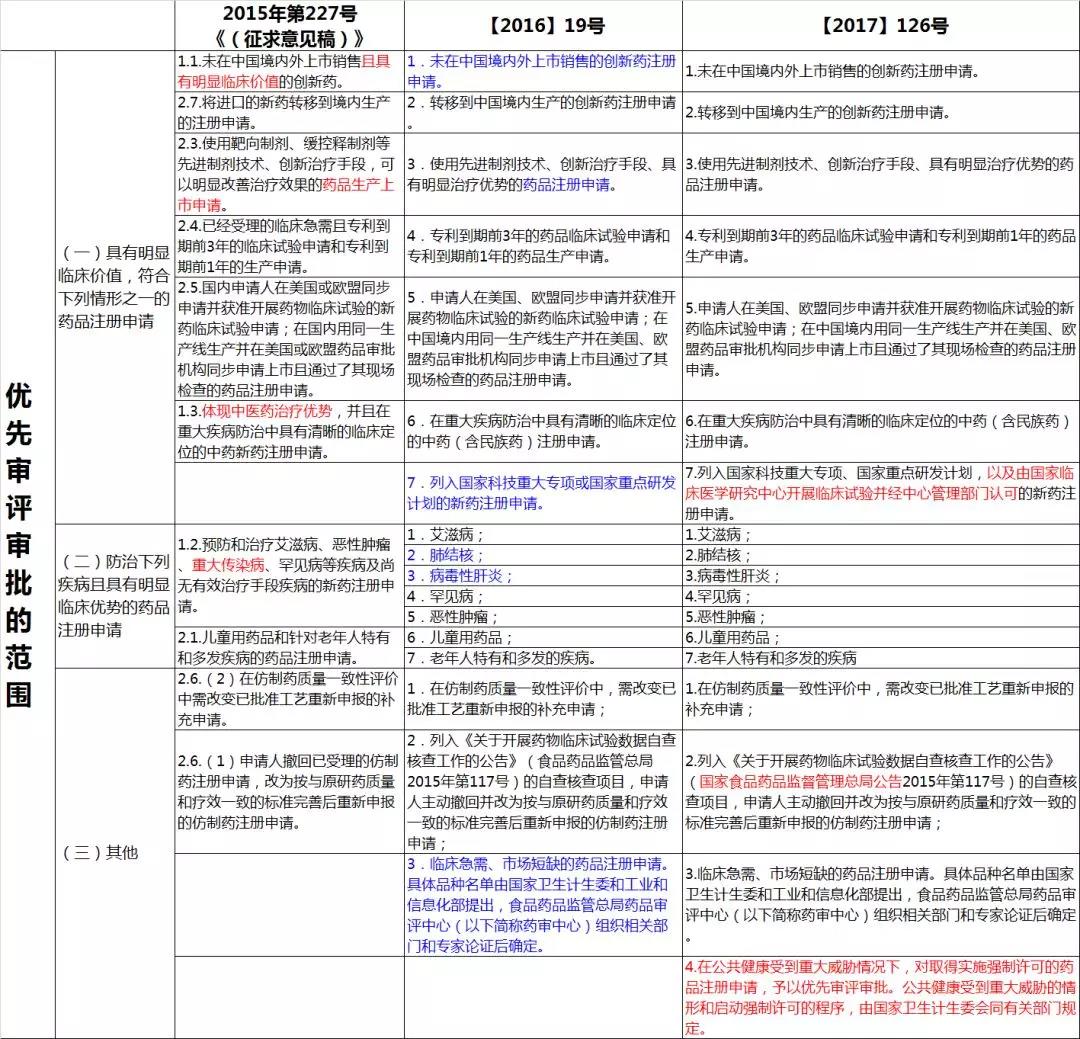
偏好一:选具有明显临床价值的
这个是硬指标。
未在国内外上市的新药,申报 1 类、1.1 类新药的很多,但是纳入优先审评的并不多,主要是卡在了「具有明显临床价值」指标上。
对于一般的国内新药产品来说,IND 阶段不可能有临床数据以证实其临床价值。
除非这两种情况:
1.该品种(国内同一厂家生产)已在国外获得临床数据——基本为外资企业或进口品种
2.新纳入药品管理的细胞疗法、基因疗法等,在获得正式临床批件前就已经作为治疗手段在临床上获得了有效性数据。
因此看优先审评审评公示目录,进口药、儿童药、临床急需等居多,而单纯的国产新药不多。只能老老实实排队审批上临床,获得临床数据后 NDA 阶段报优先。
虽然这一要求在 2016 年的文件中已经取消,但从 2016、2017 年申请和审评情况看,该思维或要求仍然在影响 CDE 对于优先审评审批申请的审核决定。
偏好二:申请阶段上放宽限制
对于先进制剂技术或治疗手段的申请由「上市申请」放宽到所有「药品注册申请」。
偏好三:不首选国家科技项目
这个不是敲门砖了。
从文件要求看,列入国家重大专项、重点研发计划的项目品种应该满足申报优先审评审批的条件。然而列入国家重大科技项目的品种,多数属于「具有明显临床价值、临床急需」或「防治重大疾病」的范畴。
也就是说,并非只要有国家科技项目立项编号,就可以享受优先审评审批。
因此在对品种是否可纳入优先审评审批审核时,仍需考虑其是否满足「全球新」、是否临床急需、是否具有治疗优势等等。
另外,2017 年最新公示的文件中加入了「由国家临床医学研究中心开展临床试验并经中心管理部门认可的新药注册申请」,个人认为是对应新《注册管理办法》中的鼓励医疗机构和研究者开展拓展性临床试验的政策。
具体如何落地,如何实施还要通过后期 CDE 公示信息分析,毕竟国家临床医学研究中心已组建有 32 家,只要是在这里完成的试验就可以享受优先审评审批,那么反而又会引发临床资源竞争紧张,想必这并不是监管部门想看到的。
偏好四:专利强制许可药品可加速
2017 年文件增加了「在公共健康受到重大威胁情况下,对取得实施强制许可的药品注册申请,予以优先审评审批」,再次强调了前期政策中专利强制许可药品加速审评审批,释放出不让专利成为药物创新、抢仿的绊脚石的信号。
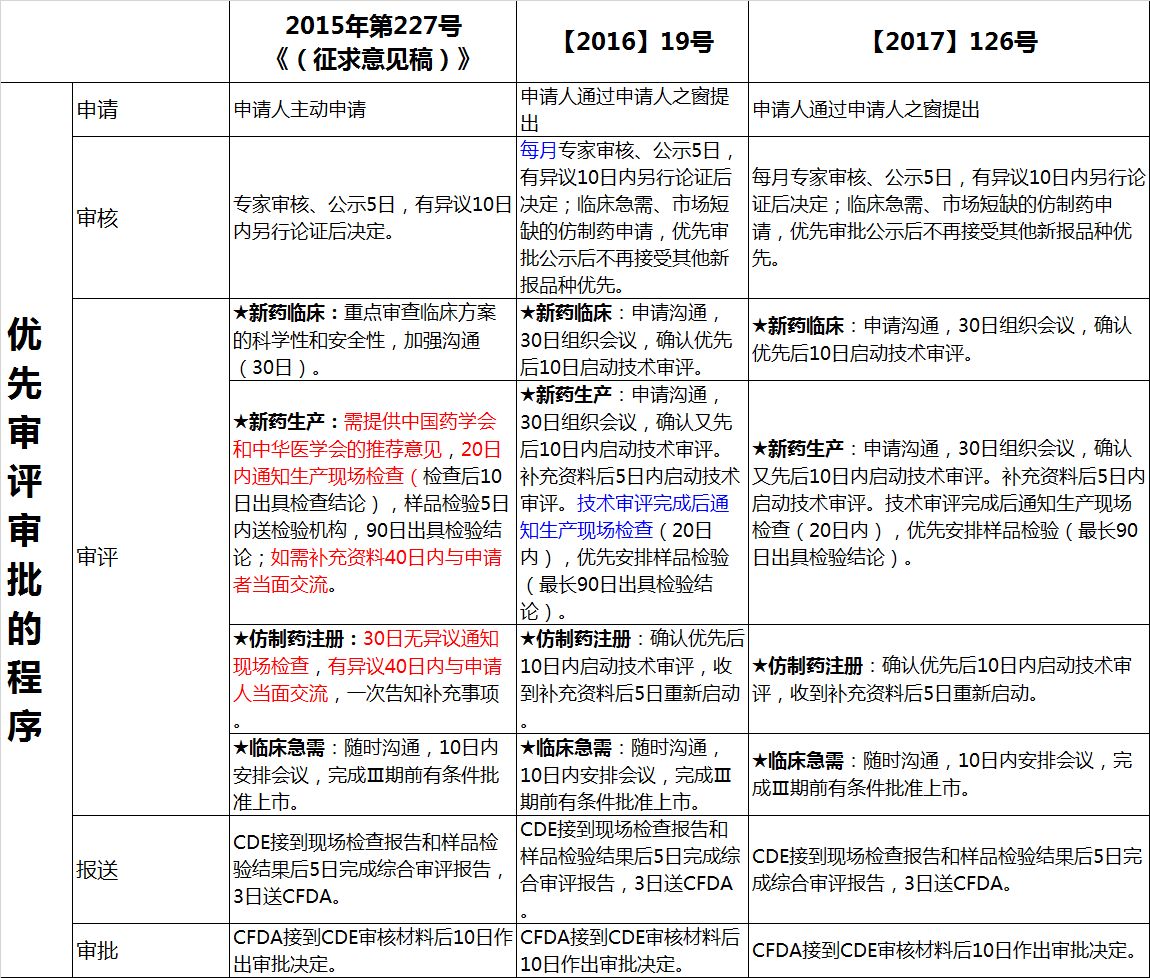
下面整理了总局 2015、2016、2017 三个关于优先审评公告内容的变化,供您参考:








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57