2018年5月29日晚,国家药品监督管理局发布公告,修订柴胡注射液说明书(如下图),除了增加警示语,不良反应、禁忌、注意事项修订外,最引起大众关注的一项是禁忌项中的儿童禁用,其中最主要的原因是柴胡注射液的多项不良反应(参见下图)。

中药注射剂主要有三类,第一类是清热解毒类,主要用于呼吸系统 疾 病 的 治 疗 ; 第 二 类 是 活 血 化瘀类,多用于心脑血管类方面的治疗;第三是补益正气类的,主要是抗肿瘤治疗。根据2017年度国家药品不良反应监测年度报告中显示的数据,2017年药品不良反应/事件报告涉及的怀疑药品中,中药例次数排名前10位的类别分别是理血剂中活血化瘀药(31.1%)、清热剂中清热解毒 药(9.5%)、补益剂中益气养阴药(8.7%)、开窍剂中凉开药(8.2%)、解表剂中辛凉解表药(5.6%)、祛湿剂中清热除湿药(4.9%)、祛湿剂中祛风胜湿药(3.0%)、祛痰剂中清热化痰药(2.3%)、补益剂中补气药(1.7%)、理血剂中益气活血药(1.5%) ,另外中药注射剂和中药口服制剂所占比例分别是54.6%和37.6%。
中药注射剂的安全问题,多是由于中药注射剂的不良反应导致,从早期的鱼腥草注射液、刺五加注射液不良反应事件,再到2009年双黄连注射液致死事件以及2017年9月,红花注射剂和喜炎平由于在全国多地发生严重不良反应被国家食药监总局紧急召回,随后9月23日,国家食品药品监督管理总局(CFDA)发布通告,叫停了喜炎平注射液。
中药注射剂之所以产生不良反应,究其根源,主要有以下几点:
★中药注射剂研发时处方药物选择的误区 中药注射剂复方产品居多,而且大量非药典法定品种原料的使用,其质量标准、化学成分、**大小等少有参考资料和标准可依,直接威胁中药注射剂的质量稳定性和安全性,增加了发生不良反应的机会。
★中药注射剂上市前临床试验的局限 局限性主要表现在临床试验病例量小,试验过程短等因素。
★中药注射剂质量标准偏低 质量标准不能控制其内存的多重成分。
★中药注射剂生产工艺落后 虽然目前提倡的中药生产现代化,一些生产厂家引进了先进的生产设备,改进了生产工艺,但是还是存在许多老旧的生产工艺,影响最严重的就是中药注射剂中的杂质残留,最终影响其质量稳定和使用安全。
★中药注射剂临床使用不规范 这也是普遍存在的问题,近年来随着中药注射剂品种受限,临床上使用量已减少很多,但是临床使用过程中仍存在中西药配伍不合理,超大剂量使用,滴注方法、加药方式以及滴注速度不当等临床使用不规范的现象,这些因素也可能导致不良反应的发生。
★中药注射剂上市后安全再评价不足 我们今天重点谈论这个问题。
中药注射剂安全性受到质疑,中药注射剂的再评价工作迫切提到日程,下面我们就以柴胡注射液说明书修改作为契机,回顾一下中药注射剂的再评价的历程:
先看一下中药注射剂行业政策汇总图:
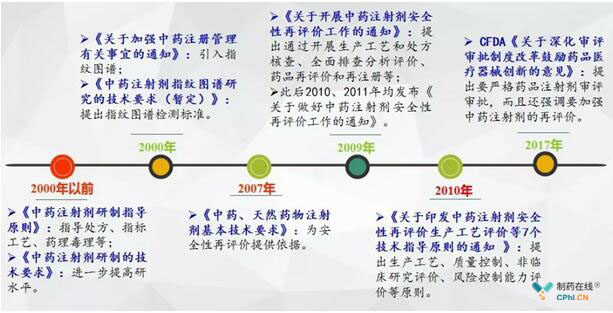
中药注射剂安全性再评价工作基本上始于2009年,2009年,国家食品药品监督管理局发布了《关于做好中药注射剂安全性再评价工作的通知(食药监办[2009]359号)》,称将分期分批对中药注射剂的重点品种进行风险效益评价,第一批拟开展风险效益评价的品种为双黄连注射剂和参麦注射剂。通知中要求全面开展生产及质量控制环节的风险排查,切实控制中药注射剂安全隐患;组织综合评价,保证中药注射剂安全有效质量可控;加快中药注射剂标准提高工作,保证产品质量加快中药注射剂标准提高工作,保证产品质量。之后在关于做好2010年中药注射剂安全性再评价工作的通知中公布了第二批再评价品种包括鱼腥草注射液和鱼金注射液。
2010年CFDA发布了"中药注射剂安全性再评价7项技术指导原则",明确提出中药注射剂开展安全性再评价,这7项技术指导原则包括了生产工艺评价技术原则、质量控制评价技术原则、非临床研究评价技术原则、临床研究评价技术原则、风险控制能力评价原则、风险效益评价技术原则以及风险管理计划指导原则,但是企业开展的这部分工作国家相关部门至今未启动官方审评和评价。
2017年10月,中药注射剂再评价正式提上日程。2017年10月8日,中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》提出,未来将严格药品注射剂审评审批,同时对已上市药品注射剂进行再评价,力争用5至10年左右时间基本完成。
中药注射剂再评价的难点在于,药品中的成份不像化学药那么明晰,成分复杂;而且在制备过程中,工艺对有效成分的影响,目前判断依据不多。另外,大部分中药注射剂上市所依据的临床数据不是很充分。
基于上述特点,中药注射剂的有效性、安全性和质量可控性都是一直被制药行业所高度关注的。随着CNDA再次启动中药注射剂再评价工作,业界和公众都非常期望这次再评价在方向科学、数据扎实丰富、各项评价工作客观公正基础上逐步开展。
参考文献:
1.《从"鱼腥草注射液事件"看中药注射剂不良反应产生的根源》
2.国家药品不良反应监测年度报告(2017年)
3.2009年中药注射剂再评价相关指导原则
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57