毒理学研究是药物非临床安全性评价过程中重要环节,目的在于在研新药用于人体之前以及在临床研究进行过程中,阐明靶器官的**反应、剂量相关性、**与药物暴露的关系以及**反应的可逆性。这些信息有助于估算首次用于人体试验的安全起始剂量和剂量范围、选择监测临床不良反应的指标,为确保临床受试者的安全提供重要的科学依据。毒理数据是介于临床前和临床之间的桥梁,全面理解毒理数据对临床试验设计具有重要意义。
临床前需要做的常规毒理试验如下:

对于急性**试验,FDA不要求做,因为这么多动物提供的数据参考价值不大。但目前CFDA是要求做的,如果缺了该条可能不受理。安全药理试验,如果该药发现心脏**问题,可能需要对心脏**机制补充研究,如果该药有主要靶标和次要靶标,次要靶标活性很强,这时需要进行次要药效学或补充的安全药理研究。对于注射剂需要做过敏试验(包括主动全身过敏,被动皮肤过敏试验)和溶血性试验(体内、体外溶血)。
关于遗传毒理试验,抗肿瘤药物可以在IND之后临床II期开展是没有问题的。对于生物药指导原则不要求进行遗传**试验,原因是大部分生物药作用于细胞表面,而不进入细胞内,所以生物药产生遗传**的可能性较小(如果大分子药物作用靶点和生长因子相关,可能要做)。
生殖毒理试验,现在作为ICH成员国,IND前可以不做生殖毒理,但需要符合以下要求:申请临床试验的试验例数不超过150例,且长毒试验中生殖器官没有出现**。
重复给药**试验是药物非临床安全性研究的重要组成部分,是综合性最强、获得信息最多、对临床指导意义的一项毒理学试验,其试验结果可判断受试物的**靶器官,预测受试物可能引起的临床不良反应,确定未观察到**反应剂量水平(NOAEL),从而根据NOAEL推算推测第一次临床试验(FIH)的起始剂量。
从NOAEL换算成人等效剂量(HED)公式如下:HED=Animal dose*Animal Km/Human Km,
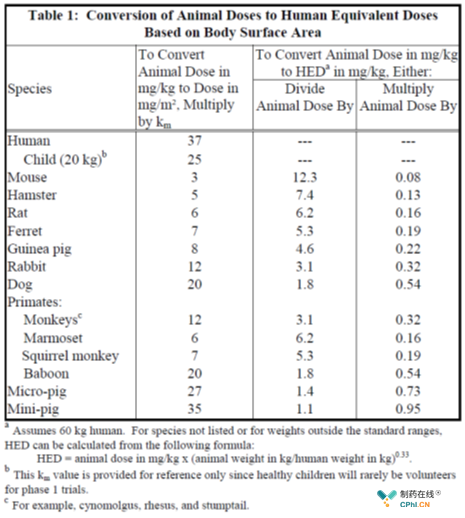
举个列子:比如比格犬重复给药**试验,NOAEL为5 mg/kg,HED=5 mg/kg*20/37=2.7mg/kg。选择人安全系数(1/10到1/1000之间),如果以1/10作为起始剂量计算的安全系数,1/10*2.7mg/kg*50kg=13.5mg,13.5mg可为第一次人体实验(FIH)起始剂量的参考。此外还有以生物暴露量为基础,接近药理作用机制的推导方式,研究者最终采用的起始剂量应是各种推算方法中得到的较低剂量。
同时,动物毒理试验要和临床周期相匹配:

有些情况,如抗肿瘤药,I期临床可能受益的病人从伦理角度不能停药,一个月长毒试验可能无法支持长期临床试验。很多国内临床医院在过伦理时候因为这个问题通不过,而国外鲜有。这情况下,可以先报IND,药监局不会因为四周的毒理试验不让上临床。在不清楚人体代谢的情况下,IND前做很长的毒理试验没有太大意义。在临床I期病人人体药代数据出来后,评估该数据,未来在人身上的代谢有助于该药往前推进,就尽快启动3个月的毒理试验,从而保证临床可能获益的病人继续用药的时候,用于支持的毒理试验已经做完。在IND阶段毒理试验做的时间越长,NOAEL就越低,临床爬坡起始剂量就越低,会造成比较大的临床损失。
试验动物的选择需要注意的是:不同的靶器官动物的敏感性不一样,比如比格犬的胃肠道敏感,如果该药物有胃肠道**的话,狗是合适种属。如果是作用于凝血系统的药物,凝血系统狗和人是最接近的。尤其是对于大分子药物,一定要选择相关种属进行试验,如果选择不相关种属可能对试验数据造成误解。
对于**试验结果进行分析时,应正确理解均值数据和个体数据的意义。在分析重复给药**试验结果时应综合考虑数据的统计学意义和生物学意义,要考虑具有统计学意义并不一定代表具有生物学意义;在判断生物学意义时要考虑参数变化的剂量-反应关系、其他关联参数的改变、与历史背景数据的比较等因素。在分析毒理数据时一定要注意生理波动,血压、心律、内分泌等都存在生理波动。还有一点是不要轻易用动物个体差异解释异常数据,哪怕1/100只动物出现个体差异且呈量效关系,也不能排除是药物引起。
将长期**研究结果外推指人体时需要注意:不同种属或个体之间对于受试物的**反应存在差异。比如:1)啮齿类动物没有胆囊,胆汁淤积性肝损伤或胆管增粗时,易出现胰 腺损伤,而人狗猴绝对不会出现,这是和生理结构相关。所以不要因为在老鼠身上看到一大堆胰 腺疾病眼睛就睁大,可以在临床上设计胰 腺不良反应指标。2)啮齿类动物牙齿不断增长,作用于EGFR靶点的抑制剂,会导致老鼠断牙,不能推到人。3)狗是特别容易产生过敏或类过敏反应,如对吐温80超敏,极易出现肥大细胞脱颗粒。如果制剂中含吐温80,不适合选狗做毒理试验。4)药物作用靶点在不同种属和人体分布不同。比如PCSK9靶点,长毒NOAEL剂量用在生殖毒试验中是致死剂量,死亡的原因是肝 脏**。通过查文献和追加试验,发现PCSK9靶点在怀孕啮齿类动物中肝 脏是高表达的。5)有些靶点人和动物的敏感性不一样。像现在做的比较多的分子靶向药,特别是抗肿瘤药物,他们的共同特点是:和人相比的话,动物的耐受性不好,敏感性很差,人是相反的。所以往往这一类药物安全窗临床前和临床不一样,比如阿帕替尼。6)免疫原性,中国目前更偏向于临床前免疫原性研究,临床前动物免疫原性结果对于推到人,参考价值并不大。国外很多大企业临床前免疫原性是不做的,我们中国做的意义是用它来解释毒理数据。7)毒理研究中给药剂量较高,供试品在动物体内可能呈非线性动力学代谢过程,从而导致与人体无关的**。8)人与动物代谢产物不同导致的**反应。比如代谢产物导致的**,药物在人体能检测出代谢产物,而在动物中均检测不出来,就无法为临床提供数据支持。
一个好的临床设计人员,根据毒理上所出现的反应、所提示的靶器官,应该对这些有所把握,但一个原则,在临床设计的时候必须首先假设人最为敏感,长期**研究中动物的**反应有可能在临床试验中再现。本着这样的原则去设计实验,才能限度的保证人体实验安全。
对于治疗一般性疾病的药物,临床用药人群广的,安全窗非常重要。一定要分析毒理NOAEL,尽可能发现死亡剂量,了解死亡原因;对于"无毒"的药首先要考虑是否在体内暴露;特别要重视以导致猝死的靶器官**:心脏、中枢神经、过敏休克等;要考虑临床病人在病理状态下对靶器官**的放大,前期为遗传**阳性的药要慎重;对离子通道有影响的药要慎重。
总之,毒理学研究为临床提供首剂剂量和耐受剂量设计的依据,为临床不良反应提供观察指标,为临床设计充分考虑种属差异、关注重要靶器官**提供支持。要假定人是对**反应最敏感的前提下设计方案,限度的保障人体实验安全。
作者简介:磐盛,目前在国内一家上市公司从事临床前项目管理工作,工总主要负责药效、药代、毒理、IND申报,通过公司资源打造新药研究及申报整合服务平台,为客户提供一体化新药研究及全球申报解决方案。








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57