p53简介
p53基因是迄今发现与人类肿瘤相关性最高的基因。不同于传统的肿瘤因子在人类癌症中通常表达量下调或存在基因删除的状况,p53在绝大多数肿瘤细胞中会发生突变。对不同人类癌症细胞进行基因组测序的结果表明,在所有恶性肿瘤中50%以上会出现该基因的突变。由这种基因编码的蛋白质是一种转录因子,其控制着细胞周期的启动。许多有关细胞健康状态的信号向p53蛋白发送,细胞是否进入一个分裂周期就由其决定。如果这个细胞受损,又不能得到修复,则p53蛋白将参与启动过程,使这个细胞在细胞凋亡(apoptosis)中死去。有p53缺陷的细胞没有这种控制,甚至在不利条件下继续分裂。像所有其它肿瘤抑制因子一样,p53基因在正常情况下对细胞分裂起着减慢或监视的作用。细胞中抑制癌变的基因“p53”会判断DNA变异的程度,如果变异较小,这种基因就促使细胞自我修复;若DNA变异较大,“p53”就诱导细胞凋亡。
作为转录因子的一员,p53 蛋白结构域分布包括序列特异的DNA结合结构域,位于氨基酸100-300位间;核定位信号NLS位于氨基酸残基316-325;四聚体寡聚化结构域,定位于氨基酸残基334-356;C-末端非专一DNA调节结构域,同时在碰到DNA损伤时,p53 可以招募其它蛋白质到损伤部位,提供DNA损伤信号。p53蛋白主要分布于细胞核浆,能与DNA特异结合,其活性受磷酸化、乙酰化、甲基化、泛素化等翻译后修饰调控。正常的p53蛋白在细胞中易水解,半衰期为20分钟,突变性p53蛋白半衰期为1.4-7小时不等。
在某些特定类型的肿瘤细胞亚型中,p53蛋白的突变率尤其高,如卵巢浆液性癌,鳞状细胞癌及三阴性乳腺癌等。在很多类型的肿瘤中,p53基因突变的存在往往伴随着较差的患者预后。通常而言,超过75%的p53突变为发生在DNA结合结构域核心区域的单个氨基酸改变,从而导致转录活性的丧失以及功能异常性p53蛋白的累积。在所有的p53蛋白突变中,有一些热点区域,出现在不同类型的肿瘤细胞中的频率非常高,包括氨基酸残基R175、Y220、R248及R273等。另外,p53蛋白高频出现的突变还可分为两种类型,分别是构象性突变及DNA结合性突变:前者破坏了p53蛋白的结构从而使其丧失DNA结合能力;而后者则是直接改变了同DNA结合的氨基酸残基。两类突变都会导致p53转录活性的丧失,并通过与野生型蛋白的异源寡聚化而产生dominate-negative效应。
针对于p53突变型肿瘤领域的药物研发,最直接的思路是诱导突变型p53蛋白的降解或帮助其恢复野生型的功能。进一步的研究表明,突变型的p53蛋白还会产生一些致癌性功能(GOF突变,gain-of-function),从而增加了肿瘤细胞的侵袭、迁移能力及药物抗性产生的概率。因此,p53蛋白的突变对癌症的发展过程起着双重作用,一方面丧失了肿瘤抑制活性;另一方面突变后的蛋白会产生新的癌基因活性,从而促进了肿瘤的发展。而这一特性,使得p53成为肿瘤治疗中靶点选择的热门候选之一。根据设计思路的不同,候选药物可分为直接作用于突变型p53及间接作用于突变型p53蛋白两大类,将分别在上、下两文中分别加以重点论述。其中直接作用于突变型p53蛋白的研究,又分为恢复p53野生型活性的策略及诱导突变型p53蛋白降解的策略。
恢复野生型p53活性策略

CP-31398
苯乙烯基喹唑啉类化合物,来源于对能够恢复p53的DNA结合活性的高通量筛选过程。研究表明,CP-31398不仅能够在表达突变型p53的细胞系中恢复p53的功能,还能够显著增加野生型p53的表达水平。采用CP-31398处理细胞,可增加p21基因的表达及细胞周期阻滞的出现。实验还发现,CP-31398可诱导p53的线粒体转位,从而导致线粒体膜通透性的改变及后续细胞色素c的释放,并进一步引发肿瘤细胞的凋亡。在携带有自然突变的p53的黑色素瘤及结肠癌异源移植模型中,CP-31398处理可明显抑制两类肿瘤组织的生长。该药物在200mg/kg / day剂量时仍表现较为安全,小鼠持续给药14天,为观察到死亡案例出现。另有研究组证实,该化合物还可以修复紫外线诱导的突变导致的肿瘤抑制活性损伤。服用CP-31398后,不仅可以抑制UVB诱发的皮肤癌生长,还可阻止其进一步发展。上述研究表明,CP-31398是一种极具潜力的靶向突变型p53的候选药物。
P53R3
采用体外DNA结合实验筛选出的新型p53功能恢复性化合物,在胶质瘤细胞系中可恢复内源性表达的p53R175H及p53R273H的序列特异性DNA结合能力。P53R3抑制细胞增殖的原理在于可诱导p53下游靶基因的表达,如MDM2,p21,PUMA及BAX等。该化合物诱导的p53下游靶基因的表达似乎具有p53突变细胞特异性,在野生型细胞中该现象较为少见。另外,P53R3可强烈增加DR5 (death receptor 5)在细胞表面的表达量,从而使得细胞对于Apo2L/TRAIL诱导的细胞死亡更加敏感。该化合物是p53功能恢复性药物开发重要候选之一。
NSC319726
能修复突变p53R175结构和功能。具体来说这种化合物能通过广泛细胞凋亡,杀死p53R175H敲除小鼠,以175等位基因特异性突变p53依赖模式,抑制异种移植肿瘤生长。研究还证明,这种活性还依赖于NSC319726的锌离子螯合特性,以及氧化还原反应。这些数据都表明NSC319726可以作为p53R175H重新激活剂,用于p53靶向药物研发。研究者的筛选方法比较独特,因涉及了癌细胞的多种遗传背景,研究者识别出的化合物可以杀死含有p53基因突变的癌细胞,其中有一种化合物可以恢复基因p53-R175H的突变,而且研究者确保人体的正常细胞是不会受这种化合物影响的。也就是说在这项研究中发现的NSC319726能恢复突变体的作用,并且对正常p53细胞不造成影响。
PK7088
p53蛋白的Y220C突变体有一个独特的表面裂缝区域,非常适合于作为小分子稳定剂的靶点,而PK7088则被筛选出可以特异性的结合并稳定p53Y220C分子。通过恢复p53的野生型构象,上调p21及促凋亡蛋白NOXA的表达量,PK7088可以在肿瘤细胞中诱导产生p53Y220C分子依赖性的G2/M细胞周期阻滞,细胞凋亡及生长抑制。除此之外,PK7088还可以同Nutlin-3产生协同作用,进一步上调p21及NOXA蛋白的表达量。
Chetomin
中文名毛壳菌素。可恢复p53的转录激活活性,并上调MDM2,p21及PUMA的表达水平。在小鼠肿瘤异源移植模型中,chetomin可选择性的抑制携带有p53R175H的肿瘤细胞生长,而不是p53R273H类型的肿瘤细胞。Chetomin可结合并增强Hsp40同p53R175H间的相互作用,从而导致p53R175H的构象变化及功能恢复。尽管如此,也有研究发现在表达野生型p53的结肠癌中,chetomin同样可以抑制肿瘤细胞生长,似乎表明该化合物的抗肿瘤活性不具有p53突变依赖性,有待进一步探讨。
PEITC
异硫氰酸苯乙酯,来源于十字花科蔬菜的天然产物,可以在肿瘤细胞中重新激活突变p53分子的正常活性。研究人员发现,PEITC对表达p53R175H的肿瘤细胞具有生长抑制活性;并能恢复其野生型构象及转录激活活性。与此同时,PEITC还可使得p53R175H肿瘤细胞对蛋白酶体介导的降解过程敏感。从作用机理上分析,PEITC通过激活经典的p53下游靶基因,使得肿瘤细胞出现S期及G2/M期细胞周期停滞,并诱导细胞凋亡过程的发生。在小鼠的肿瘤异源移植模型中,通过饮食性补充PEITC能够显著抑制小鼠体内肿瘤细胞的生长。这事首次发现的饮食中包含的化合物具有激活突变型p53活力的功效,为治疗p53R175H型癌症提供了一个新的思路。
RITA
早期研究发现该化合物可通过抑制p53-HDM2间的相互作用,诱导p53下游靶基因如p21和PUMA等分子的表达而抑制p53野生型HCT 116细胞的生长,而非p53基因敲除的细胞系。进一步研究表明,RITA可以在肿瘤细胞中诱导凋亡基因如NOXA,p21及GADD45等的表达而重新恢复突变的p53的功能,同时抑制癌基因如N-Myc和Bcl-2的表达。RITA作用机制尚未完全明确,有研究发现在卵巢癌中RITA诱导的细胞死亡并不依赖于p53的存在。在p53野生型的头颈癌中,RITA可以增大顺铂诱导的细胞**;而在p53突变的胰 腺癌中,RITA可协同增进吉西他滨诱导的细胞凋亡。
COTI-2
最初由制药公司Critical Outcome Technologies发现的第三代缩氨基硫脲类药物,可恢复错误折叠的p53蛋白(R175H,R273H)野生活性。COTI-2同样也是PI3K / AKT / mTOR信号通路的负向调节剂。近期研究表明,不管是否含有p53突变,在体内外的模型中COTI-1都可以降低多种肿瘤细胞的增殖,因而其同样可能作用于PI3K / AKT / mTOR等信号通路。目前该化合物已经进入一期临床研究中(NCT02433626),用于治疗晚期或复发性妇科恶性肿瘤。
PRIMA-1
PRIMA-1是一种突变型p53复活剂,可恢复p53突变型甲状腺癌细胞对组蛋白甲基化抑制剂3-Deazaneplanocin A的敏感性,并通过结合于核心DNA结合结构域而诱导细胞凋亡。该化合物在体内转化后会结合于突变型p53分子的巯基上,从而使整个蛋白恢复野生构象,而重新具有抑癌活性。
PRIMA-1Met(APR-246)
在药物优化筛选过程中,研究人员发现PRIMA-1甲基化形式的类似物,PRIMA-1Met (APR-246)具有更强的药效及更低的细胞**。APR-246通过激活caspase-3,上调促凋亡蛋白Bax及Noxa等的表达量而诱导肿瘤细胞的凋亡。除在体外实验模型中表现出色外,APR-246还同传统的化疗药物在某些癌症中存在较强的协同效应。针对APR-246的不同适应症已经进入了不同的临床试验阶段。在一项针对携带有p53突变的血液系统恶性肿瘤及前列腺癌患者的Ⅰ/Ⅱa期临床研究中,APR-246在疗效及安全性上均表现出色。而另一项Ⅰb/Ⅱ临床试验正在开展中(NCT02098343),用以评估APR-246同卡铂联用针对复发性高等级卵巢癌患者的疗效,该患者群体中约95%携带有p53基因的突变。
诱导突变型p53降解策略
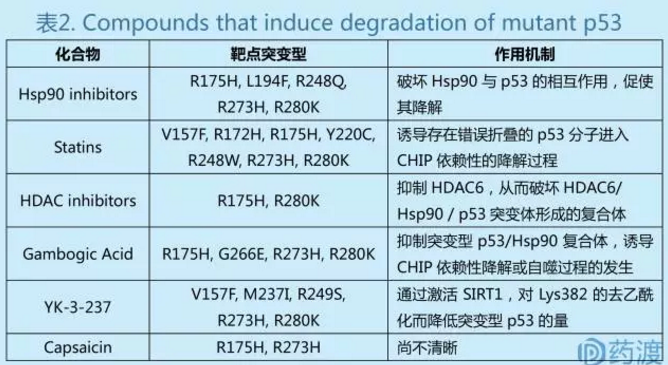
Hsp90及HDAC抑制剂
在人类所患癌症中,突变型p53分子往往要比野生型p53更加稳定,原因在于HDAC6 / Hsp90组成的分子伴侣复合体与突变型p53间存在相互作用,从而阻止了突变型p53蛋白的泛素化降解。因此,理论上通过HDAC抑制剂或者Hsp90抑制剂来破坏HDAC6 / Hsp90组成的分子伴侣复合体,将会诱导p53突变体的降解。已发表的研究结果中,Hsp90抑制剂(如17-AAG及Ganetespib)及HDAC抑制剂(如vorinostat)可以促进p53突变体进入蛋白酶体依赖性的降解过程,并且这些抑制剂已经进入了不同的临床试验阶段。Hsp90抑制剂ganetespib针对非小细胞肺癌开展了三期临床研究,但由于疗效不佳,该项目终止于第一次中期分析阶段。尽管如此,ganetespib针对其他诸如AML,卵巢癌及乳腺癌等适应症的研究正处于一期及二期临床阶段。
他汀类药物
他汀类药物通常用于降低血液中胆固醇水平,从而治疗或预防心血管疾病的发生。在一项针对能够降解突变型p53化学分子库的筛选研究中,科研人员发现他汀类化合物可诱导携带有构象或者折叠错误的p53蛋白(V157F,R172H,R175H,Y220C,R248W,R273H及R280K)的降解。他汀类药物介导的HMG-CoA活性抑制及p53分子的降解效应对携带有突变型p53的肿瘤细胞具有高度特异性,该效应在表达有野生型p53的肿瘤细胞中较弱。另外,他汀类药物还同诸如阿霉素的化疗药物间存在正协同作用,并且该现象指发生于携带有p53突变的肿瘤细胞中。因此,采用他汀类药物对甲戊二羟酸途径进行抑制也代表了靶向于肿瘤细胞中突变型p53分子的一类新型有效的药物开发策略。
Gambogic acid
中文名藤黄酸,来源于藤黄科植物藤黄树分泌的干燥树脂,可以上调野生型p53的表达量从而诱导细胞凋亡的产生。藤黄酸还可以在转录后水平下调突变型p53在细胞内的浓度,作用机理为通过CHIP泛素连接酶对不同的p53突变体进行泛素化及随后的蛋白酶体依赖性降解过程。另外,有研究表明在表达p53R280K及p53S241F的肿瘤细胞系中,藤黄酸还可通过细胞自噬过程诱导p53突变体的降解。
YK-3-237
该化合物在三阴性乳腺癌中可以诱导突变型p53的降解,其作用机理为通过活化蛋白质去乙酰化酶SIRT1来降低不同p53突变体(V157F,M237I/R249S,R273H及R280K)的乙酰化程度。p53突变体的去乙酰化会降低蛋白稳定性,上调p53下游靶基因如PUMA和NOXA等的表达。在携带有p53突变的三阴性乳腺癌中,YK-3-237更倾向于通过诱导细胞周期阻滞及PARP依赖性的细胞凋亡来抑制肿瘤细胞增殖。尽管如此,该化合物在肿瘤异源移植模型中的效果仍有待确认。
Capsaicin
辣椒素,又名辣椒碱,即反式-8-甲基-N-香草基-6-壬烯酰胺,是辣椒属植物红辣椒的活性成分。它对包括人类在内的哺乳动物都有刺激性并可在口腔中产生灼烧感。Capsaicin是一种TRPV1激动剂,作用HEK293细胞,EC50 为0.29±0.05 μM。近期的一项研究表明,capsaicin可在胶质母细胞瘤及乳腺癌细胞系中诱导p53突变体蛋白(R175H,R273H)的降解。Capsaicin处理后,细胞重新具有野生型p53分子的活力,诸如PUMA及Bax表达量的上调及诱导肿瘤细胞死亡现象的发生等。令人感兴趣的是,capsaicin同样会降低MDR1 (multidrug resistance gene)基因的表达水平,因而可以使得肿瘤细胞重新对诸如顺铂在内的化疗药物变得敏感。Capsaicin诱导突变型p53讲解的分子机理,仍有待进一步探索。
参考文献:
1.http://p53.free.fr/
2.Molecularly targeted therapies for p53-mutant cancers.Cell Mol Life Sci. 2017 Jun 22. doi:10.1007/s00018-017-2575-0
3.Allele-specific p53 mutant reactivation.Cancer Cell,2012,21 (5): 614
4.http://criticaloutcome.com/coti-2-and-pipeline/pipeline/
5.p53 in health and disease. Nat Rev Mol Cell Biol. 2007 Apr;8 (4):275-83.
6.p53 in survival,death and metabolic health: a lifeguard with a licence to kill. Nat Rev Mol Cell Biol. 2015 Jul;16 (7):393-405. doi: 10.1038/nrm4007.
7. Awakening guardian angels: drugging the p53 pathway. Nat Rev Cancer. 2009 Dec;9(12):862-73. doi: 10.1038/nrc2763.








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57