百济神州公布SEQUOIA试验的期中分析结果,这是一项在初治(TN)慢性淋巴细胞白血病(CLL)患者中进行的3期试验,此次纳入分析的数据来自对比百悦泽®和苯达莫司汀联合利妥昔单抗(B+R治疗方案)的随机队列1,以及评价百悦泽®联合维奈克拉治疗伴17p染色体缺失(del[17p])和/或致病性TP53变异基因的患者的队列3(D组)。这些数据在第63届美国血液学会(ASH)年会上进行了两次口头报告。

SEQUOIA队列1:百悦泽®对比B+R治疗方案不伴有del(17p)的TN CLL患者
口头报告;摘要#396;简要总结请见
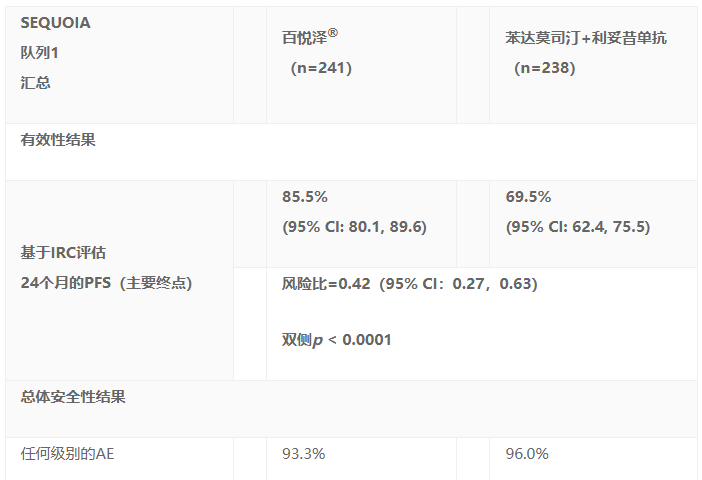
SEQUOIA试验队列1共入组479例肿瘤未显示del(17p)的TN CLL患者,其中241例患者随机接受百悦泽®治疗(A组),238例患者随机接受B+R治疗方案(B组)。两组患者特征平衡,其中50%以上的患者为IGHV基因无突变,18%的患者伴有del(11q)。del(17p)患者接受化学免疫治疗后通常疗效不佳,在队列2中被分配接受百悦泽®治疗。队列2的结果已在2020年ASH年会上公布。
SEQUOIA试验的主要终点是随机队列1中基于独立审查委员会(IRC)评估的无进展生存期(PFS)。
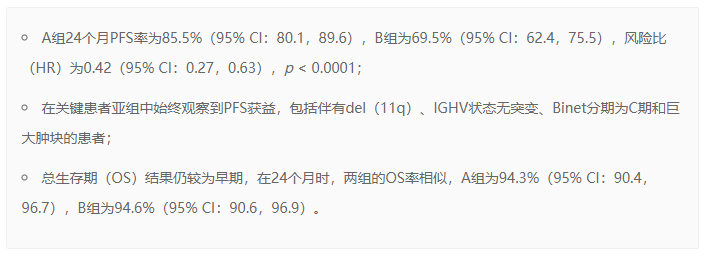
期中分析显示,在26.15个月的中位随访时间里,基于IRC的评估结果,百悦泽®在PFS方面超过B+R治疗方案。结果包括:
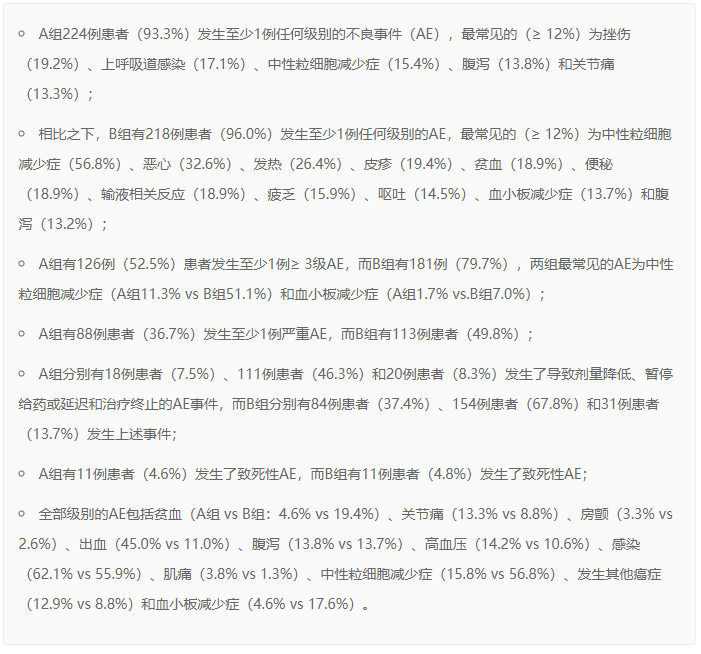
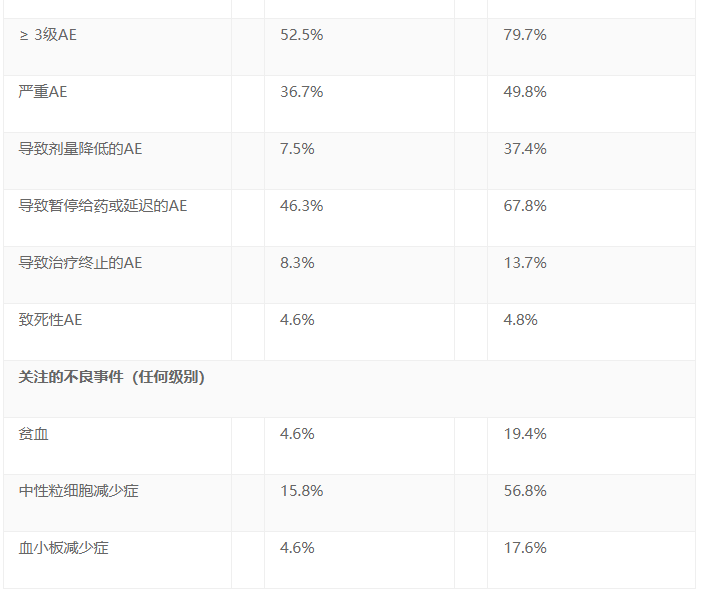
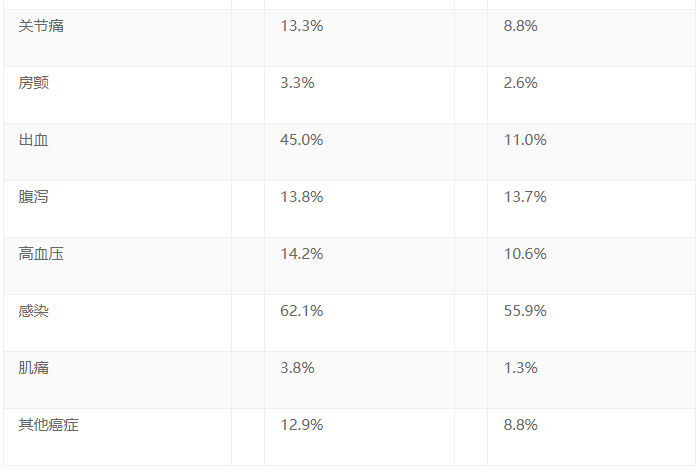
安全性分析纳入了A组240例患者和B组227例接受至少一次相应治疗的患者。百悦泽®总体耐受性良好,安全性特征与其在广泛的临床项目一致,包括较低的房颤发生率。结果包括:
此外,还在ASH年会中报告了在延长随访期的情况下,队列2(C组)百悦泽®单药治疗伴有del(17p)患者的有效性结果。在30.5个月的中位随访时间里,24个月的PFS率为88.9%(95% CI:81.3,93.6)。
SEQUOIA试验队列1的期中分析总结
SEQUOIA试验队列3(D组):百悦泽®联合维奈克拉治疗伴有del(17p)和/或TP53突变的TN CLL患者
口头报告;摘要#67
SEQUOIA试验的队列3旨在检验在百悦泽®基础上增加使用维奈克拉可促使肿瘤取得更深入的缓解的假设。基于队列2中证明的百悦泽®的安全性和有效性,队列3计划入组约80例肿瘤显示带有del(17p)或TP53突变的TN CLL患者,关键终点为安全性、总缓解率(ORR)、PFS和缓解持续时间(DoR)。这些患者将接受百悦泽®160 mg治疗,每日两次,持续3个月,随后接受相同剂量的百悦泽®联合维奈克拉治疗,剂量递增至400 mg,每日一次,持续12至24个周期,直至出现疾病进展、不可接受的**或确认检测不到微小残留病灶(uMRD)。
截至数据截止日期2021年9月7日,队列3入组了49例患者,包括46例(93.9%)集中确认为del(17p)状态阳性的患者和3例(6.1%)仅有致病性TP53变异体的患者。入组队列3的患者还显示出其他高风险标志物,包括87.8%的患者IGHV无突变、91.9%的患者并发TP53突变以及83.3%的患者复杂核型(至少3个异常)。
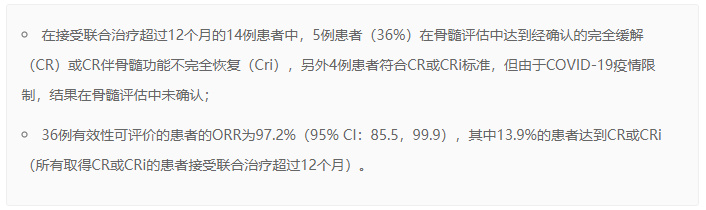
在12.0个月的较短中位随访时间时,截至数据截止日期,在至少进行过一次基线后取得缓解评价的36例患者中观察到了较高的ORR。研究者评估的初步有效性结果包括:
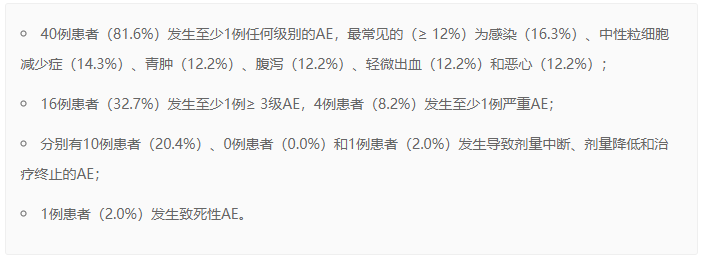
在7.9个月的中位随访时间里,所有49例入组患者的安全性结果包括:
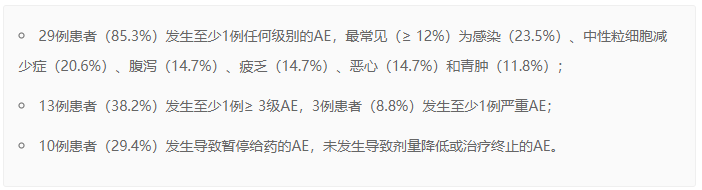
在中位随访时间为13.5个月时,34例接受联合治疗的患者的安全性结果包括:








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57