转眼之间,再鼎医药已成立近十年,虽仍未实现盈利,但光环难掩。
进入2023年,再鼎医药接连推进2款新药上市,合并已成功商业化的4款产品,成立以来,再鼎医药已成功孵化6款新药,产品上市及商业化速度之快令人咂舌。
9月5日,再鼎医药的艾加莫德注射液α注射液(卫伟迦?)正式在国内开售,同日,艾加莫德在北京、上海、广东、湖北、河南、江西、河北等全国多个省市开出首批处方。随着新药商业化落地,再鼎医药信心满满的按下了“扭亏”的加速键。
全球首 创的FcRn拮抗剂,再鼎的下一个“爆款”
艾加莫德由Argenx开发,于2021年12月获得FDA批准上市。2021年初,再鼎医药以1.75亿美元预付款和里程碑付款获得了艾加莫德的大中华区独家权益(包括中国大陆、香港、澳门和台湾地区)的独家开发和商业化权利。
在再鼎医药手里,艾加莫德进展得颇为顺利,今年6月30日获国家药监局批上市,用于治疗乙酰胆碱受体(AChR)抗体阳性的成人全身型重症肌无力(gMG)患者,成为再鼎医药在自身免疫领域里的第一款产品。
艾加莫德是一款全球首 创的FcRn拮抗剂。其能通过靶向FcRn来减少带有异常AChR抗体的IgG(重症肌无力的特征之一),从而治疗重症肌无力。在临床试验中,注射一剂efgartigimod之后,受试者体内的IgG抗体浓度能减少50%;多剂注射后,IgG抗体浓度能减少75% 。患者的抗AChR自身抗体也同样会迅速减少,并同时伴随着病情缓解。
同时,艾加莫德在国内的获批所依据的全球3期多中心临床研究ADAPT的结果也显示,该研究达到了主要终点,在第一个治疗周期中MG-ADL改善≥2分的患者高达77.8%,QMG改善≥3分的患者高达74.2%,40%的患者在第一个周期即达到最小临床表现。
关于重症肌无力药物治疗
重症肌无力(MG)是一种自身免疫性神经肌肉接头疾病,由针对突触后膜上乙酰胆碱受体、肌肉特异性激酶或其他乙酰胆碱受体相关蛋白的自身抗体引起,主要表现为波动性全身肌肉无力,伴有或不伴有眼睑下垂,严重影响患者的生活质量。全球及中国重症肌无力治疗药物市场将持续快速增长。
根据弗若斯特沙利文测算,全球MG治疗药物市场将从2020年的12.6亿美元增至2025年的30.48亿美元,CAGR达19.3%,中国市场则是从0.46亿美元增至2.5 亿美元,CAGR 达40.2%,整个MG药物市场市场前景非常客观。
当下,重症肌无力的治疗仍以胆碱酯酶抑制剂、糖皮质激素、免疫抑制剂、静脉注射免疫球蛋白(IVIG)、血浆置换(PE)以及胸腺切除为主,生物药相对较少。
目前,全球范围内治疗重症肌无力的创新生物药只有三款,分别是亚力兄的Eculizumab(依库珠单抗)、Ravulizumab(雷夫利珠单抗)以及Argenx的Efgartigimodalfa-fcab(艾加莫德),其中亚力兄的两款药物均以C5为靶点。

就目前来讲,艾加莫德以独特的作用机制逐渐成为所有重症肌无力靶向药物中,兼顾疗效与安全性的最 佳选择。而艾加莫德自上市以来,海外销售表现非常可观,2022年销售额达4亿美元,2023Q2单季收入更是达2.69亿美元,照此加速度,艾加莫德今年有望迈进“10亿美元“大品种行列。
而从国内重症肌无力市场格局上来看,艾加莫德国内获批之前,仅有依库珠单抗在售,并且艾加莫德获批时间上也完全能赶上2023年医保谈判,销售前景因此也异常光明,海外投行Jefferies预测,艾加莫德在可能2024年在MG领域为再鼎带来2500万至5000万美元的销售收入,未来在中国仅在MG适应症的销售峰值收入有望达到3-5亿美元。
最后,这还是艾加莫德仅获得MG适应症的情况,作为全球首 创FcRn拮抗剂,艾加莫德被认为是治疗抗体介导自身免疫性疾病极具潜力的一类药物,这就意味着在MG外,艾加莫德还有无限可能。
艾加莫德或将是再鼎医药的下一个“爆款”产品。
商业化能力是铁打的银盘
近年来,创新药企的竞争焦点逐渐从新靶点、新技术与早期研发向研发后期乃至商业化阶段转移。Biopharma区别于Biotech最重要的特征也正是商业化能力。
而商业化能力的形成自然也离不开销售费用的投入和销售团队的组建。从2019年第一款产品上市开始,再鼎医药销售费用逐年增加,2019年到2022年,销售费用及一般行政开支从7021万美元增加到2.59亿美元,2023年H1,再鼎医药销售及一般行政开支半年就高达1.3亿美元,同比大增295.8%,而据再鼎医药年报内容显示,其增加的巨额费用就是用于销售团队的组建及今年上市的两款产品的后期商业化提前做铺垫。
目前,再鼎医药已经组建了近1000人的商业化团队。面对新药的商业化,再鼎医药也曾表示,在大中华区(中国内地、香港、澳门和台湾地区)都配备了约100人商业化团队,及时响应市场需求,以最快速度的推进商业化工作。
艾加莫德从国内获批到正式开售仅用时67天,创下了国内进口生物制剂从获批到上市的最快记录,再次向大众展现了再鼎医药强大商业化“内功”。
两年不到的时间,再鼎医药相继推出4款新产品上市,速度之快让人惊讶,随之而来的也是对其商业化能力的巨大考验。
从近几年营收情况来看,则乐、爱普盾、擎乐、纽再乐销售额均在逐年上涨,再鼎医药用最真实的产品销售业绩直面考验。
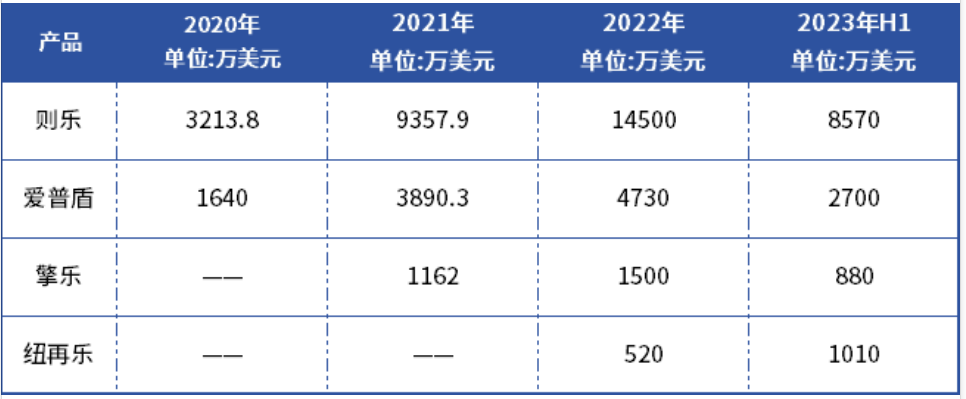
其中,泽乐2022年营收1.45亿美元,约合人民币10.15亿元,成为年售10亿的大单品,且实现了国内PARP抑制剂37%市场份额,2023H1半年销售8570万美元,未来还将持续提升,德邦证券预计销售峰值超25亿人民币。
另外,2021年12月在国内上市的纽再乐,上市首年就卖出520万美元,2023H1营收1010万美元,本年就实现翻倍增长,势头相当迅猛。
如今,艾加莫德正式开售,开始贡献营收。刚刚在9月1日获批上市的马吉妥昔单抗也随之进入商业化推广的准备阶段,相信过不了多久,也会迎来马吉妥昔单抗落地开花结果的喜讯。
盈利拐点将至
根据2023H1财报,今年上半年再鼎医药实现营业收入1.3亿美元(折合人民币约9.5亿),同比增长38.74%。净利润方面,亏损总额为1.43亿美元(折合人民币约10.3亿),亏损较去年同期有所收窄约20%。
目前,再鼎医药正在进行或计划进行的临床研究超50多个,拥有全球权利的内部研发项目9个,已上市产品有6款,研发管线涉及有肿瘤、感染性疾病、中枢神经系统疾病、自身免疫性疾病等四大治疗领域。
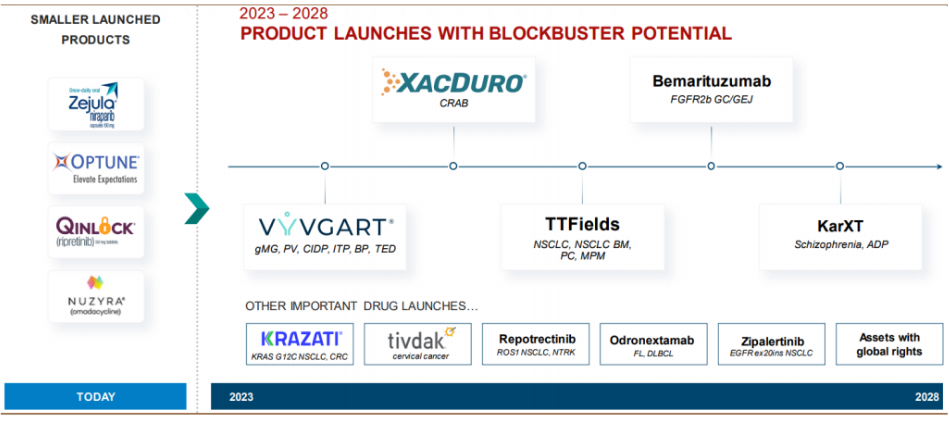
除已上市6款产品,还有多个产品处于临床三期或关键期临床阶段:KRAS G12C抑制剂Adagrasib, FGFR2b抑制剂Bemarituzumab,CD3XCD20双抗、FIC的TF ADC新药Tivdak、精神分裂症新药KARXT等产品均处于临床后期或关键期阶段,有望于在未来两年申报上市。
其中,9月4日,Seagen和Genmab刚刚联合宣布,再鼎医药在2022年9月从Seagen引进的Tivdak(tisotumab vedotin)治疗复发或转移性宫颈癌成人患者的III期innovaTV 301研究达到了总生存期(OS)主要终点。这对于再鼎医药,无疑又是一大利好消息。
总体来说,未来2-3年,再鼎将进入后期管线获批的爆发阶段,预计会有至少8款产品在中国获批。
新药叠加已上市产品,在优秀的商业化团队的强力催化下,再鼎医药盈利指日可待。








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57