
疫苗临床试验的质量控制是一个繁复而细致的过程,需要对疫苗临床试验的关键环节进行把控。鉴于这一现实需求,中国疫苗行业协会于2024年4月12日正式在官网发布了《疫苗临床试验现场实施质量控制工作规范(征求意见稿)》,广泛征求各方意见,意见征集将于2024年5月11日截止。该指南提供了疫苗临床试验现场实施质量控制工作的管理分级、人员资质、质控内容、质控流程、质控计划、质控实施、问题分析及处理等实施标准。适用于疫苗临床试验的试验现场开展疫苗临床试验的质量控制工作。
一、疫苗临床试验对质量控制的相关法规要求
疫苗临床试验作为疫苗研发流程中的核心环节,对于保障疫苗的安全性和有效性具有至关重要的作用。为确保试验过程的严谨与规范,相关法律法规对试验现场制定了详尽且严格的法规要求。质量控制,作为临床试验质量保证体系中的关键组成部分,旨在通过一系列技术和活动,确保临床试验的每一个环节都符合既定的质量要求。以下是对疫苗临床试验相关法律法规中质量控制相关要求的梳理:
(1) 2013年10月31日,国家食品药品监督管理总局发布了《疫苗临床试验质量管理指导原则(试行)》,对疫苗临床试验的规范与质量控制提出了明确要求。根据该文件,负责机构需向总局申请资格认定,获批后方可组织试验,并负责管理与质控。试验前,负责机构还需制定统一标准操作规程,确保各试验现场严格执行。此外,临床试验质控员在项目协调员的协助下,对现场质控工作进行管理,确保试验流程符合方案与GCP要求,包括受试者知情同意、疫苗管理、标本采集、不良事件核实以及数据修改规范等,从而保障试验的科学性与安全性。
(2) 2020年4月27日,国家药品监督管理局与国家卫生健康委员会联合修订并发布了《药物临床试验质量管理规范》,自同年7月1日起正式实施。规范强调,申办者需确保临床试验各环节的可操作性与简洁性,避免流程和数据采集过于复杂。试验方案及相关文件应清晰、一致。规范明确,申办者可委托合同研究组织执行部分或全部工作,但申办者仍为数据质量和可靠性的最终责任人,需监督受托组织的工作。申办者还需制定、实施并更新质量保证和质量控制系统的标准操作规程,确保试验全程严格遵循质量管理标准,数据处理各阶段均有质量控制,以保障数据的可靠性和处理过程的正确性。
(3) 《药物临床试验机构管理规定》是国家药监局与国家卫生健康委于2019年11月29日联合发布的重要文件,并于同年12月1日正式实施。该规定明确指出,药物临床试验机构应设立或指定专门的药物临床试验组织管理部门,负责统筹药物临床试验的立项、试验用药品、资料及质量管理等工作,旨在持续提升药物临床试验的质量水平。同时,第十四条强调,主要研究者应全面监督临床试验的实施过程,确保各研究人员履行职责,并采取有效措施实施质量管理,从而保障试验数据的可靠性与准确性。这些规定的实施,有助于规范药物临床试验行为,提升试验质量,为药物研发的安全性和有效性提供有力保障。
二、临床试验现场质量控制实施要点
运用计划-实施-检查-处理(PDCA)的循环质控流程模式对项目质量进行闭环把控。临床试验现场质量控制组织管理图(示例图)如下图:
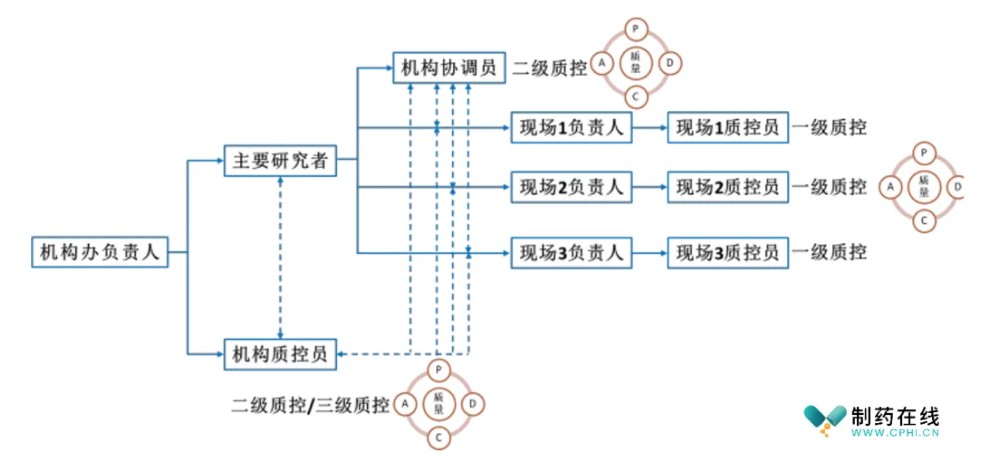
1. 质控计划
质控计划包括目的、人员、职责、流程、实施时间及内容、发现问题及处理、记录和报告等内容,质控计划编制的重点和难点是实施时间及检查目的和内容,示例如下表:
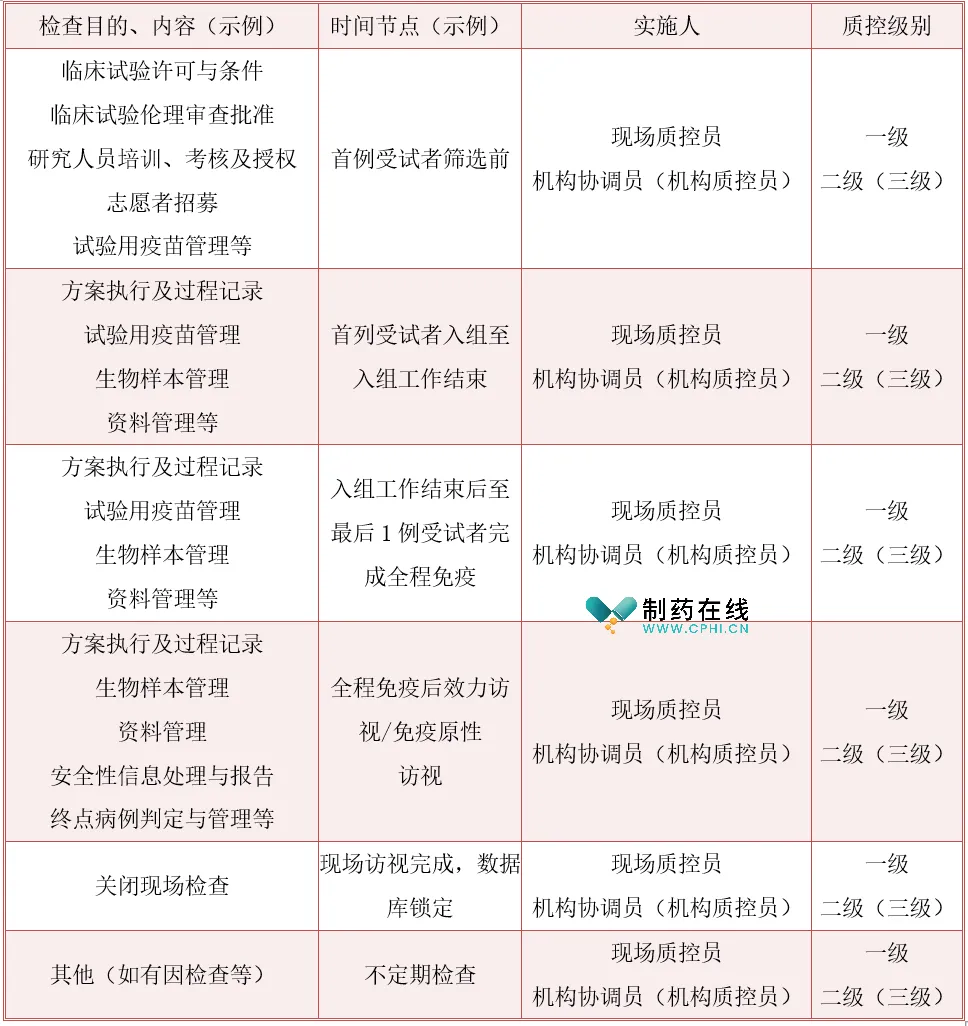
2. 质控内容
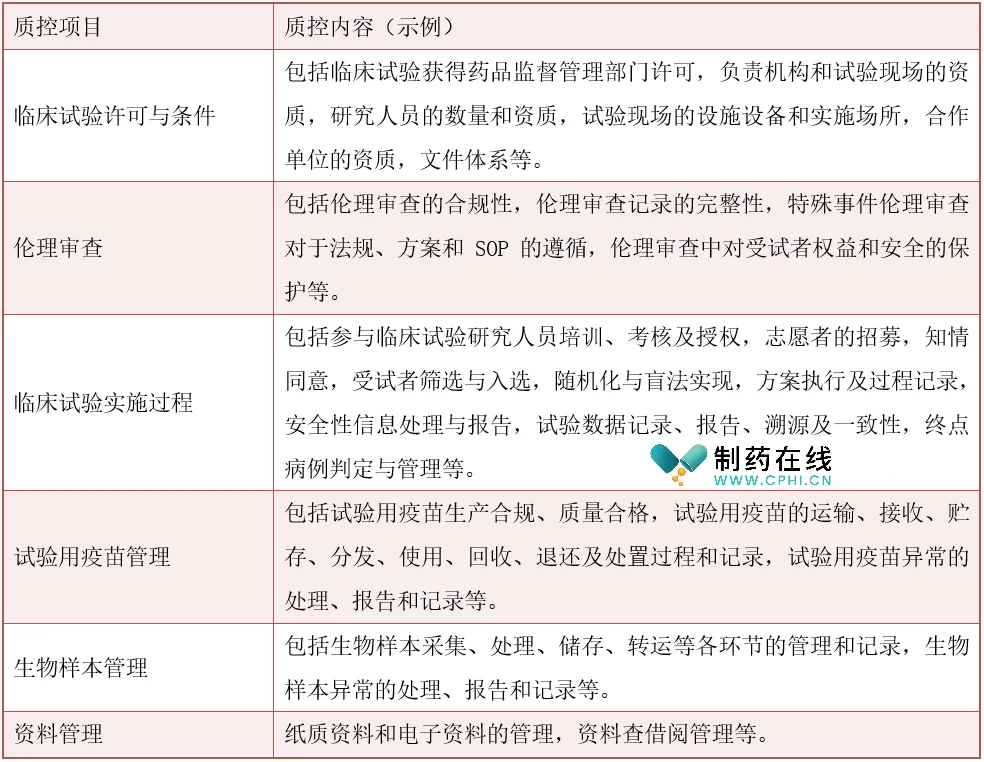
质控内容是疫苗临床试验中至关重要的一环,它涉及多个方面的要素,确保试验的合规性、安全性和有效性。以下是对这些质控内容的简要概述:
(1) 临床试验许可与条件是质控的基石。这包括确保试验获得药品监督管理部门的正式许可,以及负责机构和试验现场具备相应的资质。同时,研究人员的数量和资质也是评估许可条件的重要方面,他们需要具备足够的专业知识和经验,以确保试验的顺利进行。
(2) 伦理审查是质控不可或缺的一环。它涉及对试验方案、知情同意书等文件的合规性审查,以及确保受试者权益和安全的保护。伦理审查的完整性和合规性是保障试验道德性和合法性的关键。
(3) 在临床试验实施过程中,质控涉及多个方面的管理。这包括研究人员的培训、考核和授权,以确保他们具备进行试验所需的技能和知识。同时,志愿者的招募、知情同意、受试者筛选与入选等环节也需要严格遵循相关规范。此外,试验数据的记录、报告、溯源及一致性也是质控的重要内容,以确保数据的准确性和可靠性。
(4) 试验用疫苗管理是质控的另一关键要素。这包括确保疫苗的生产合规、质量合格,以及运输、接收、贮存、分发、使用等各个环节的严格管理。对于疫苗的异常情况,需要及时处理、报告和记录,以确保试验的安全进行。
(5) 生物样本管理是质控中不可忽视的一环。它涉及样本的采集、处理、储存、转运等各个环节,需要确保样本的完整性和可靠性。同时,对于样本的异常情况,也需要采取相应的处理措施并记录。
(6) 资料管理是质控的重要组成部分。这包括纸质资料和电子资料的管理,需要建立完善的资料管理制度,确保资料的完整性、准确性和可追溯性。同时,资料的查借阅管理也需要规范,以保障资料的安全性和保密性。
质控内容涵盖了临床试验的各个方面,从许可条件到伦理审查,再到实施过程、疫苗管理、生物样本管理和资料管理。通过严格的质控措施,可以确保疫苗临床试验的合规性、安全性和有效性,为疫苗的研发和上市提供有力保障。主要质控内容示例如下表:
三、《疫苗临床试验现场实施质量控制工作规范》标准信息

【参考文献】
中国疫苗行业协会等
【作者简介】
滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57