全球药物批准/研发动态
01
全球新药批准情况
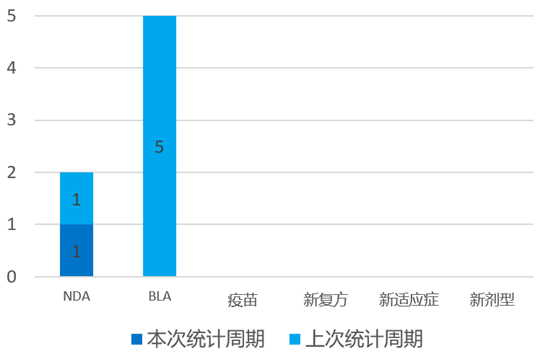
根据药渡数据统计分析,本次统计周期(2024.04.13-04.19)全球(不含中国)共有8个新药获批上市。其中,NDA批准1个,BLA批准1个,新适应症批准5个,新剂型批准1个。与上个统计周期相比,本增加4个批准新药。
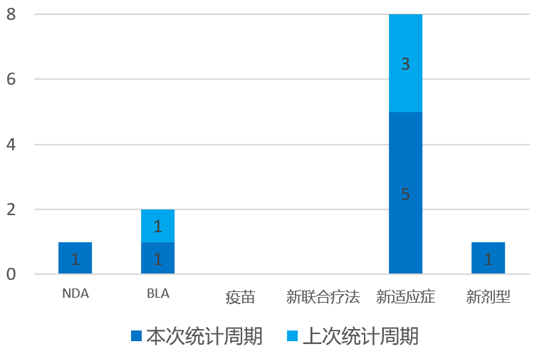
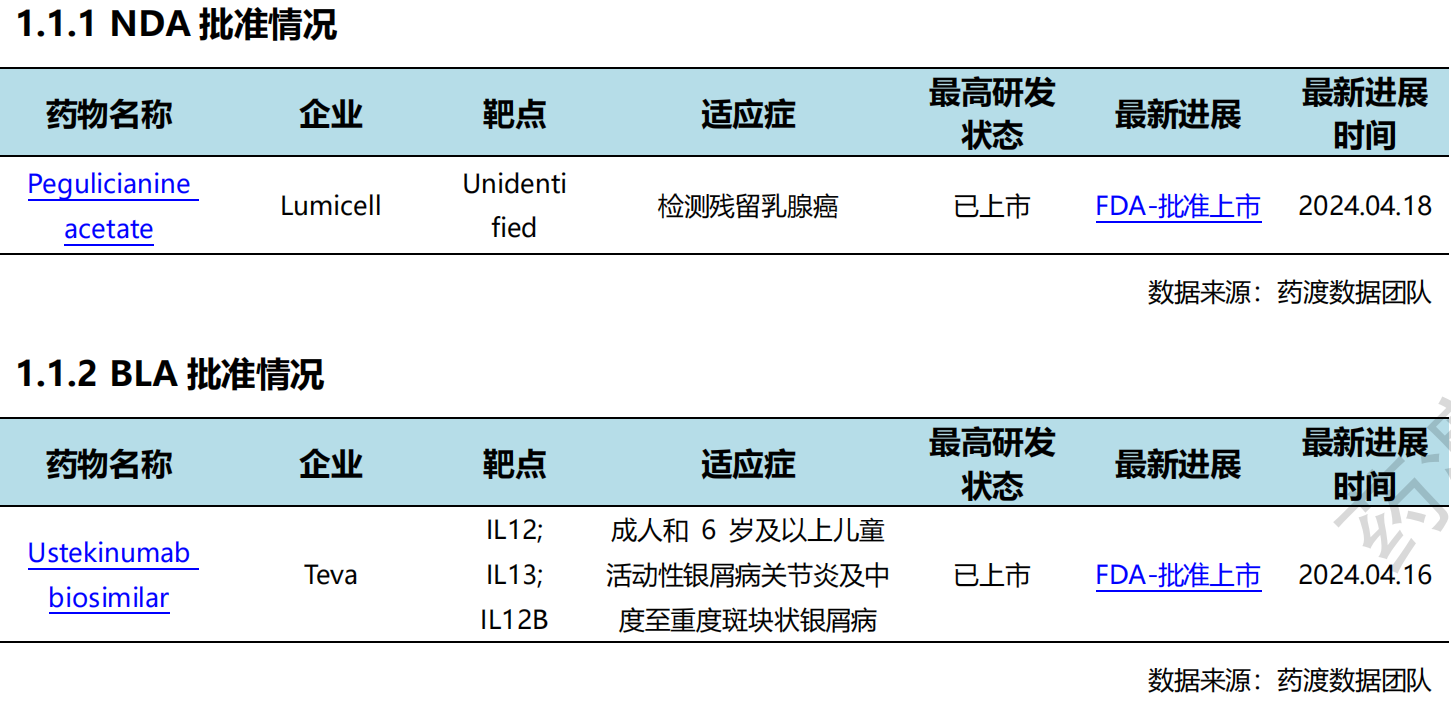
4月16日,Teva宣布FDA已批准SELARSDI(Ustekinumab-aekn)注射液皮下使用,作为Stelara的生物类似药,用于治疗成人和6岁及以上成人和儿童患者的中度至重度斑块状银屑病和活动性银屑病关节炎。Ustekinumab 是一种人源单克隆抗体(mAb),可选择性靶向p40蛋白,p40蛋白是白细胞介素(IL)-12 和 IL-23 细胞因子的共同成分,在治疗免疫介导的疾病(如银屑病和银屑病关节炎)中起着至关重要的作用。
4月18日,Genentech宣布FDA已批准Alecensa(Alectinib)用于肿瘤切除后的辅助治疗,用于间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌(NSCLC)(肿瘤≥4厘米或淋巴结阳性)患者。Alecensa是目前第一个也是唯一一个被批准用于接受手术切除肿瘤的ALK阳性早期NSCLC患者的ALK抑制剂。ALINA的III期研究显示Alecensa将ALK NSCLC患者的疾病复发或死亡风险降低了76%。
全球(不含中国)新药批准情况(部分)
02
全球新药申报进展
本周暂无相关药物申报。
根据药渡数据统计分析,本次统计周期(2024.04.13-04.19)全球(不含中国)共有7个药物获监管机构特殊资格认定。其中,化学药2个,生物药5个。与上次统计周期相比,本次减少2个获监管机构特殊资格认定的药物。
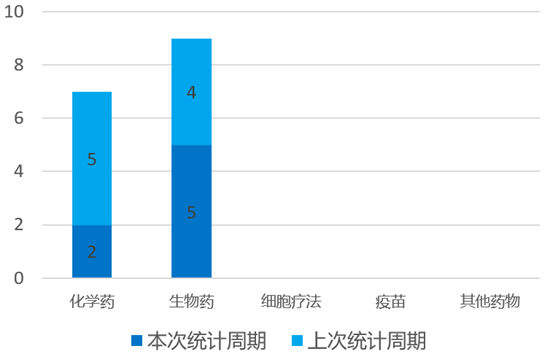
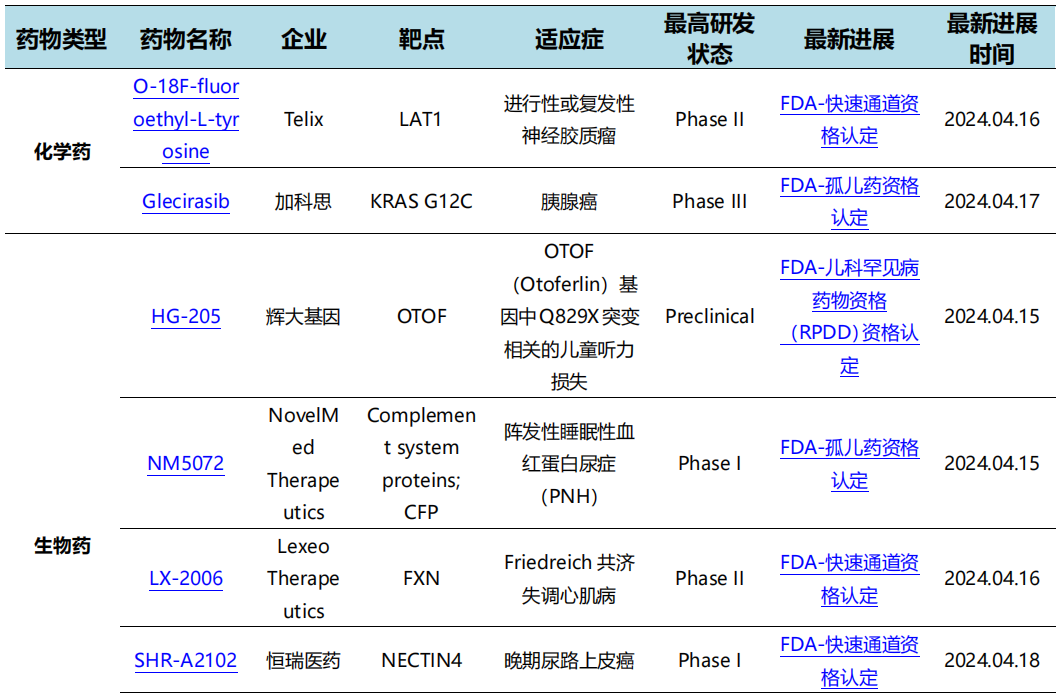
4月17日,加科思药业宣布其自主研发的KRAS G12C抑制剂Glecirasib胰腺癌适应症被FDA授予了孤儿药资格认定。此前,Glecirasib已被CDE授予用于KRAS G12C突变的二线或以上胰腺癌患者治疗的突破性治疗药物认定。此前在2024年美国临床肿瘤学会胃肠癌研讨会年会(2024 ASCO GI)以口头报告形式公布了二线及以上的KRAS G12C突变胰腺癌患者数据,确认客观缓解率为41.9%(13/31),疾病控制率为93.5%(29/31),中位无进展生存期(mPFS)为5.6个月,中位总生存期(mOS)为10.7个月。
4月18日,恒瑞医药宣布其自主研发的Nectin-4抗体偶联药物(Antibody-drug-conjugate, ADC)注射用SHR-A2102获FDA授予快速通道资格,用于治疗晚期尿路上皮癌。SHR-A2102是靶向Nectin-4的抗体药物偶联物(ADC),其有效载荷是拓扑异构酶抑制剂(TOPi),多种研究表明Nectin-4在肿瘤中的高表达与肿瘤的发展和不良预后密切相关。
特殊资格认定情况(部分)
03
全球新药研发进展
根据药渡数据统计分析,本次统计周期(2024.04.13-04.19)全球(不含中国)新药临床研发状态更新共计44条,涉及肿瘤、血液和淋巴疾病、遗传代谢病、精神疾病、神经疾病以及眼部疾病等共计12个领域。
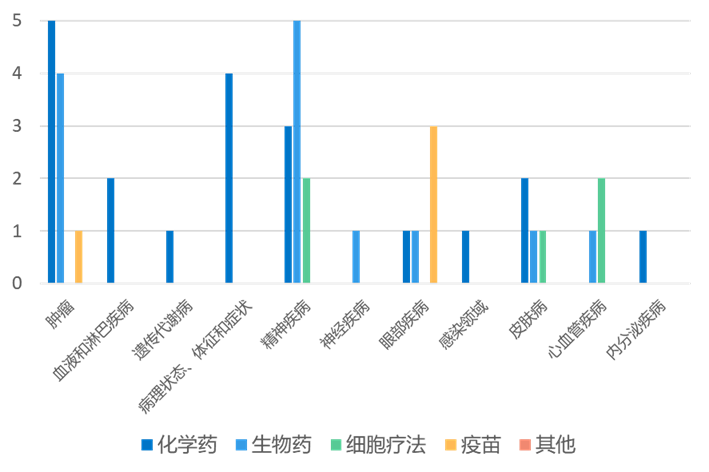
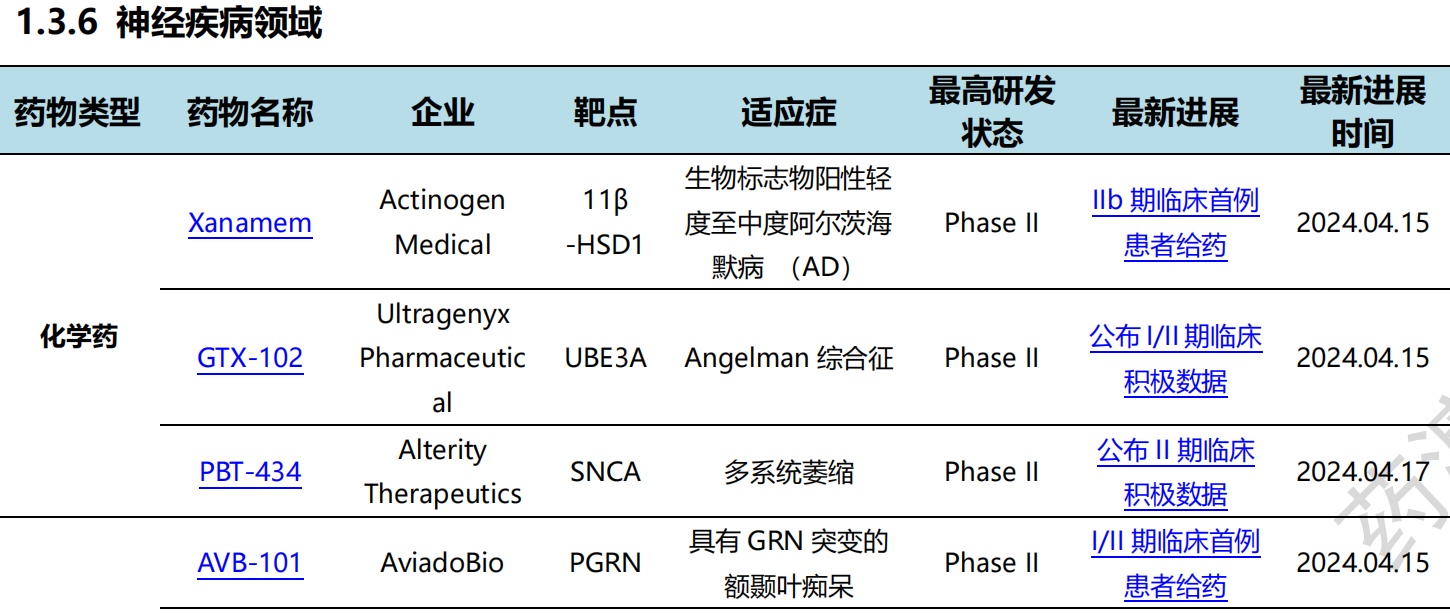
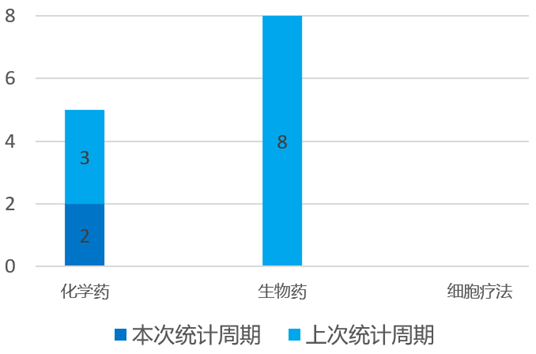
其中,神经疾病领域临床进展更新居各领域之首,涉及化学药3条,生物药5条,细胞疗法2条。
4月19日,劲方医药宣布KRAS G12C抑制剂GFH925单药疗法获得FDA临床试验许可,可针对KRAS G12C突变型难治、转移性结直肠癌患者开展一项多中心、开放标签、随机对照III期试验。这是全球首 个临床获批的KRAS G12C抑制剂单药治疗结直肠癌III期试验,GFH925也是国内首 个获得晚期结直肠癌突破性疗法认定的KRAS G12C抑制剂。。
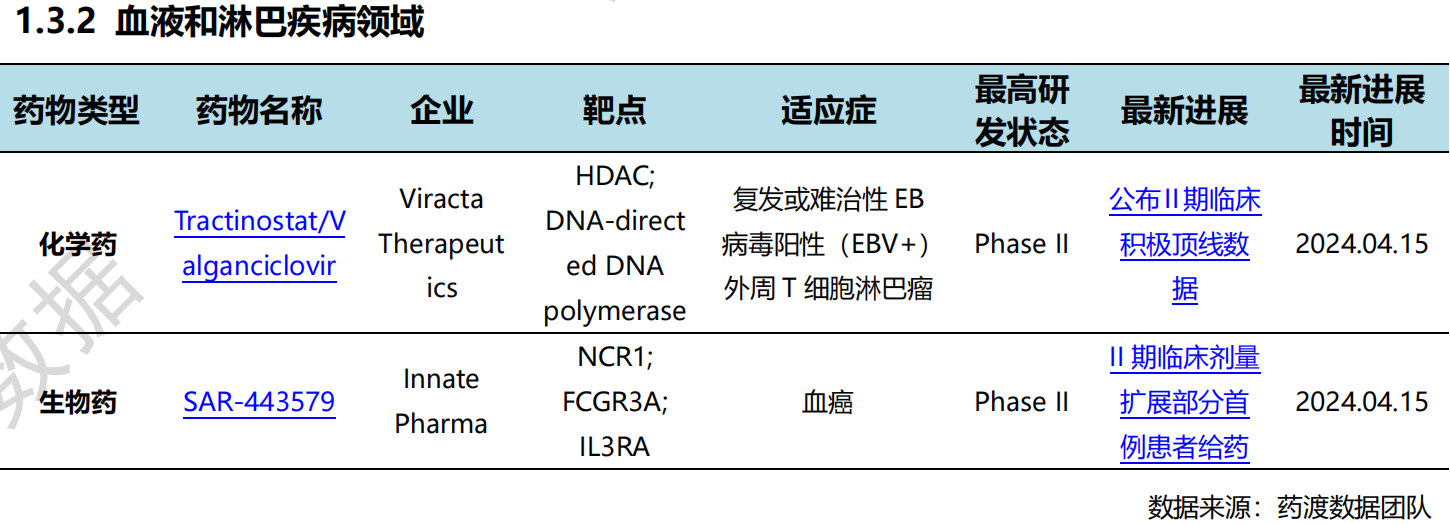
同日,丹码生物宣布在DM919的一项首次在人体中进行的I期的临床试验中, 首例受试者在美国已完成入组。DM919是D2M 自主研发的、靶向MICA/B蛋白的人源化单克隆抗体,通过恢复和促进T细胞和自然杀伤(NK)细胞的抗肿瘤反应,用于治疗晚期实体肿瘤。此外,当DM919与抗PD1药物联合应用时,已经表现出了显著的协同抗肿瘤效果。
全球新药研发进展详情(部分)
04
全球医药交易事件
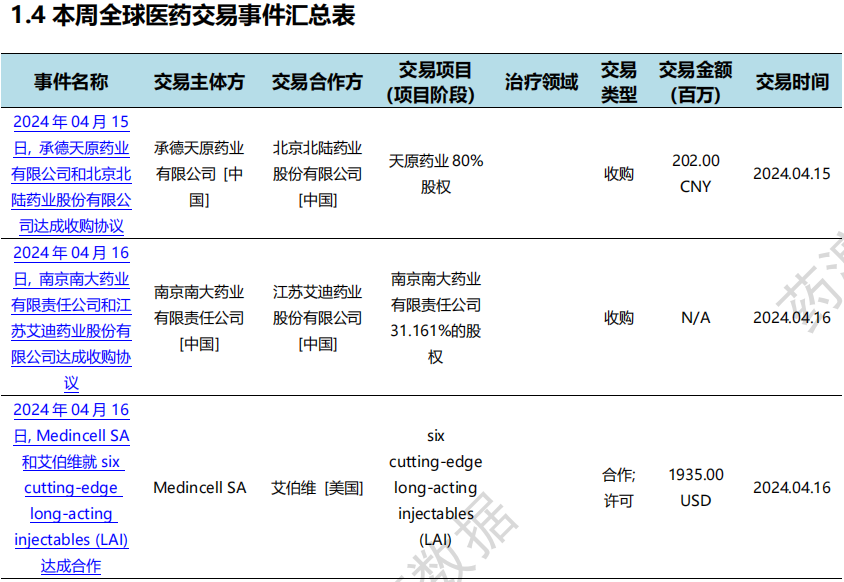
本次统计周期(2024.04.13-04.19)全球(含中国)医药交易时间共计12起,涉及药物权益转让、公司并购等多起交易事件。
全球医药交易时间汇总表(部分)
国内药物批准/研发动态
01
国内新药批准情况
根据药渡数据统计分析,本次统计周期(2024.04.13-04.19)国内共有1个新药获NMPA批准上市。其中, NDA批准1个。与上次统计周期相比,本次减少5个NMPA批准新药。
4月16日,康哲药业宣布澳门特别行政区批准磷酸芦可替尼乳膏新药上市申请,用于治疗12岁及以上青少年和成人患者伴面部受累的非节段型白癜风。该产品是第一种也是唯一一种在美国获批使用的局部JAK抑制剂,用于12岁及以上非节段型白癜风患者的局部治疗,以及传统外用处方疗法不可取或不能充分控制病情之12岁及以上成人和儿童非免疫功能低下的轻中度特应性皮炎(AD)患者的短期和非持续性慢性治疗。
两项国际多中心(包含美国和欧洲中心)关键临床研究显示:治疗24周后,与赋形剂组相比,芦可替尼乳膏治疗组患者面部和全身皮损有显著复色;52周数据表明,随着治疗时间的延长,患者皮损持续复色。
中国新药批准情况(部分)

02
国内新药临床默示许可进展
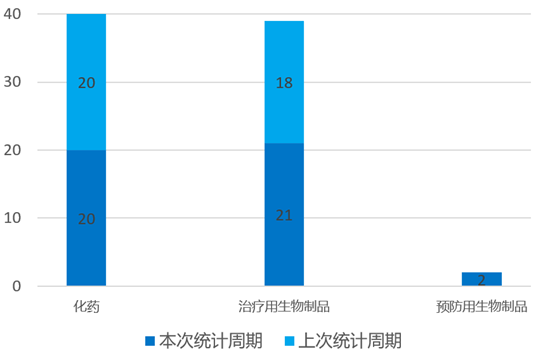
根据药渡数据统计分析,本次统计周期(2024.04.13-04.19)国内共有43个新药获临床默示许可,涉及70个受理号。其中,化学药20个,治疗用生物制品21个,预防用生物制品2个。与上个统计周期相比,本次增加17个临床默示许可获批受理号。
本周国内新药临床默示许可进展(部分)
03
国内新药申报进展
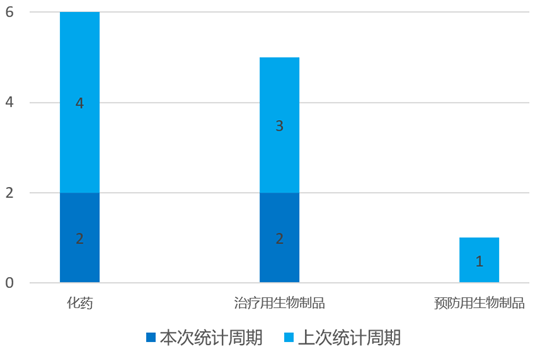
根据药渡数据统计分析,本次统计周期(2024.04.13-04.19)国内共有4个新药申报上市,涉及6个受理号。其中,化学药2个,治疗用生物制品2个。与上个统计周期相比,本次减少8个新药申报上市受理号。
国内新药申报上市情况(部分)
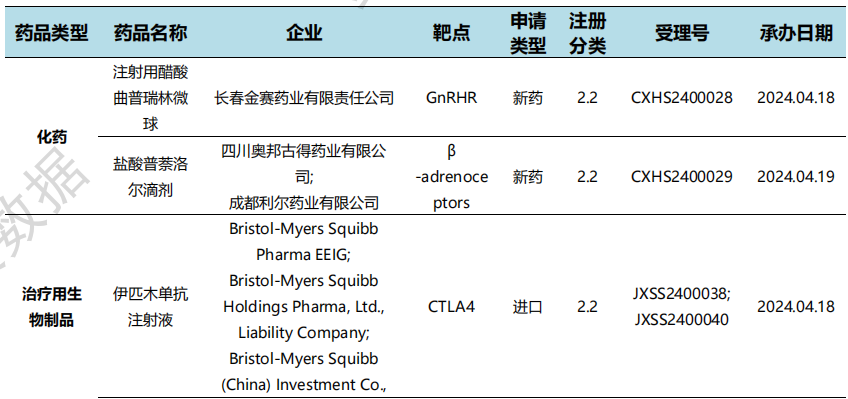
根据药渡数据统计分析,本次统计周期(2024.04.13-04.19)国内共有43个新药申报临床,涉及68个受理号。其中,化学药23个,治疗用生物制品17个,预防用生物制品3个。与上个统计周期相比,本次增加12个临床申报受理号。
国内新药临床申报情况(部分)
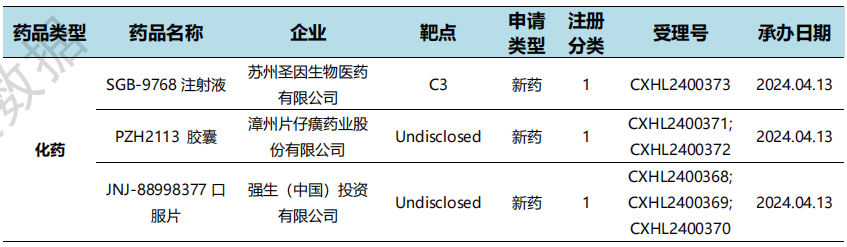
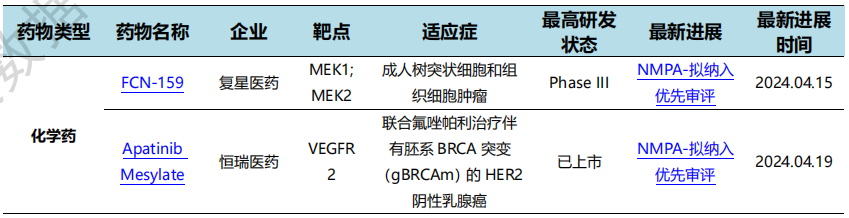
根据药渡数据统计分析,本次统计周期(2024.04.13-04.19)国内共有3个药物获NMPA特殊资格认定。其中,化学药3个。与上个统计周期相比,本次增加1个获监管机构特殊资格认定的药物。
4月19日, CDE官网公示,恒瑞医药两款创新药拟纳入优先审评,针对适应症为:氟唑帕利胶囊单药或联合甲磺酸阿帕替尼用于伴有胚系BRCA突变(gBRCAm)的HER2阴性乳腺癌患者的治疗。值得一提的是,这两款药针对该适应症的申请已于今年3月被CDE纳入突破性治疗品种。
氟唑帕利是恒瑞医药研发的1类创新药,为一种新型口服PARP抑制剂。该药已经在中国获批用于胚系BRCA1/2(gBRCA1/2)突变的铂敏感复发性卵巢癌治疗,以及铂类敏感复发性卵巢癌维持治疗,无论胚系BRCA1/2突变状态如何。
阿帕替尼是恒瑞医药研发一种高选择性的靶向血管内皮细胞生长因子受体2(VEGFR2)的抗血管生成药物,已经在中国获批单药治疗晚期胃腺癌或胃-食管结合部腺癌、晚期肝细胞癌,以及联合卡瑞利珠单抗治疗不可切除或转移性肝细胞癌。
NMPA特殊资格认定情况(部分)
04
国内新药研发进展
根据药渡数据统计分析,本次统计周期(2024.04.13-04.19)国内新药临床研发状态更新共计2条,涉及肿瘤、血液和淋巴疾病共计2个领域。其中,化学药2个。
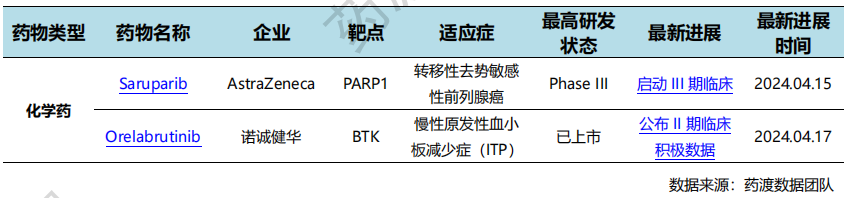
4月17日,诺诚健华布鲁顿酪氨酸激酶(BTK)抑制剂奥布替尼治疗慢性原发性血小板减少症(ITP)患者的II期临床研究结果。该研究旨在评估奥布替尼治疗慢性ITP成人患者的疗效和安全性。结果显示,奥布替尼有望为ITP患者提供安全有效的治疗方案。
此次研究的主要终点是血小板计数至少连续两周达到≥50×109/L(前4周内未使用补救药物)的患者比例。总共入组33例患者。在每天一次口服50毫克和30毫克的奥布替尼治疗ITP患者的两个组别中,奥布替尼都展现了良好的安全性。奥布替尼治疗ITP患者的III期注册临床正加速推进中,预计2024年年底完成患者入组。
国内新药研发进展情况
05
国内新药研发领域政策法规动态
国家药监局药审中心关于发布《药审中心关于已上市药品说明书增加儿童用药信息工作细则(试行)》的通知(药审业〔2024〕162号)
为落实《已上市药品说明书增加儿童用药信息工作程序(试行)》中药品审评中心制定品种遴选范围、说明书修订与审核流程,以及品种申报程序等相关配套文件的要求,我中心制定了《药审中心关于已上市药品说明书增加儿童用药信息工作细则(试行)》(见附件),经国家药品监督管理局审核同意,现予发布,自发布之日起施行。
06
国内新药研发领域热点新闻
Novartis超10亿美元押注PROTAC---蛋白水解靶向嵌合体
诺华于本周四(4月11日)与Arvinas建立独家战略合作伙伴关系,推进前列腺癌的口服蛋白降解剂(PROteolysis TArgeting Chimera,PROTAC)。诺华公司将支付给Arvinas1.5亿美元的预付款,并承诺在开发、监管和商业里程碑上支付超过10亿美元的费用,外加分级特许权使用费。
根据上述协议,诺华公司将负责ARV-766的全球临床开发和商业化。该交易还包括销售Arvinas在mCRPC中的临床前AR-V7项目(针对全长AR及其剪接变体AR-V7的下一代蛋白质降解剂)。诺华将拥有AR-V7项目的所有研究、开发、制造和商业化权利。
TYK2:家族“异类”,大有可为
进入2024年以来,三家Biotech的多轮融资将酪氨酸激酶2(TYK2)靶点的热度再次点燃。2024年1月,Sudo Biosciences宣布完成了第二次B轮融资,并在2月额外筹集了3000万美元,使这家TYK2开发公司的B轮融资额达到了1.47亿美元。
同样在1月份,TYK2公司Myrobalan Therapeutics宣布完成2400万美元的A轮融资,用于开发口服神经修复疗法,包括用于减少神经炎症的TYK2变构抑制剂。
聚焦抗病毒,凯因生物「赢得市场」
在新冠疫情之前,抗病毒药物一直未得到充分的重视,全球抗病毒药物研发相比癌症、慢性病领域少之又少。近年来,新冠病毒的全球流行让抗病毒药物研发得到大量关注,资本快速流入,相关研发项目加速上马。
同样在1月份,TYK2公司Myrobalan Therapeutics宣布完成2400万美元的A轮融资,用于开发口服神经修复疗法,包括用于减少神经炎症的TYK2变构抑制剂。
喜大普奔!恒瑞医药终于营利双增重回正轨
终于止跌回升,恒瑞医药的拐点要来了。
根据最新年报显示,2023年,恒瑞医药总营收228.2亿元,同比增长7.26%;净利润43.02亿元,增长10.14%;归母扣非净利润41.41亿元,增长21.46%。在连续两年总营收和净利润下跌之后,恒瑞医药终于再度雄起,强势扭转下滑趋势,回到增长正轨。虽然这是恒瑞医药一家药企的喜讯,但作为最能代表中国制药行业的风向标,也昭示着集采对整个制药行业的影响基本出清,历史包袱已经卸下。长风破浪会有时,直挂云帆济沧海。
不只有八因子,神州细胞还有秘密武器
近日,神州细胞公布最新年报数据,2023年,其总营收18.87亿元,同比增长84.46%;净亏损3.96亿元,同比缩小23.70%;归母扣非净亏损6368.05万元,同比缩小83.91%。随着八因子的大爆量,以这样的增长速度进行下去,神州细胞很快就要实现扭亏为盈,实在不易。但这是意料之中的事,毕竟其八因子实在过于强悍。但与开挂式的营收增长趋势不符,神州细胞在资本市场的表现实在不能令人满意。
不过在另一“爆款”即将浮现之际,或许神州细胞将会再展雄风。








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57