4月12日,信立泰发布公告称,公司及子公司信立泰(苏州)药业有限公司、信立泰(成都)生物技术有限公司收到国家药监局核准签发的受理通知书,“特立帕肽注射液”临床试验申请获得受理。
药品基本情况
特立帕肽注射液适应症拟为用于有骨折高发风险的绝经后妇女骨质疏松症的治疗。该产品拟为每天一次,且注射前无需溶解,直接皮下注册,更方便患者使用。
骨质疏松症是以低骨量及骨组织微结构退变为特征的一种全身性骨骼疾病,伴有骨脆性增加,易发生骨折。2018年中国居民骨质疏松症流行病学调查显示,骨质疏松症已经成为我国50岁以上人群的重要健康问题,中老年女性骨质疏松问题尤为严重。
随着人口老龄化加剧,骨质疏松药物存在较大的市场潜力。特立帕肽是目前唯一已经上市的能调节新骨合成从而增加骨量、改善骨结构的药物,被公认为治疗骨质疏松症的理想药物之一。
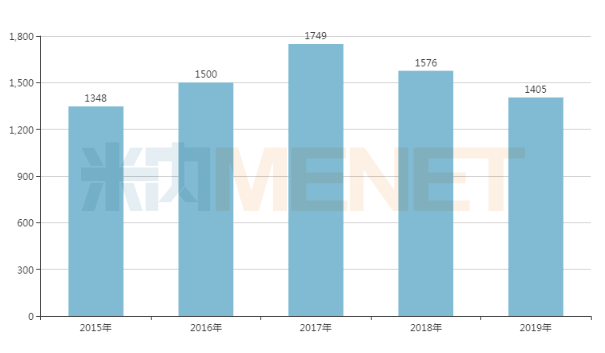
特立帕肽注射液(商品名复泰奥)原研厂家为礼来,2011年在国内获批。礼来财报显示,2019年复泰奥全球销售额为14亿美元。国内已有两款特立帕肽生物类似药获批,分别为上海联合赛尔生物、信立泰的注射用重组特立帕肽。特立帕肽注射液是信立泰在骨科领域的再度布局。
礼来特立帕肽全球销售情况(百万美元)
信立泰表示,特立帕肽注射液临床申请获得受理后,尚需获得临床试验默示许可、按国家药品注册的相关规定和要求开展临床试验,待临床试验成功后按程序申报生产。
来源:上市公司公告、米内网数据库








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57