3月28日,Maruho公司宣布Mitchga(nemolizumab)在日本被批准用于治疗特应性皮炎(AD)相关瘙痒(对现有疗法效果不佳),这意味着全球首 款IL-31受体靶向疗法获批上市。

nemolizumab是中外制药研制的一款IL-31受体A靶向单抗。IL-31是2型辅助T细胞(Th2细胞)释放的一种细胞因子,通过与神经元表达的IL-31受体A互动,参与AD相关搔痒,同时在AD皮肤炎症和AD皮肤屏障破坏中发挥作用。2016年,Maruho公司从中外制药授权获得在日本市场开发和商业化nemolizumab用于皮肤疾病领域的权利,Galderma公司从中外制药授权获得nemolizumab的全球(日本和中国台湾除外)权利。
此次nemolizumab获批是基于其在日本开展的治疗AD相关瘙痒的III期临床研究的积极结果。该研究共入组215例年龄在13岁以上的AD患者,这些患者存在中度至重度瘙痒。研究中,患者以2:1的比例随机分配,接受每4周一次皮下注射nemolizumab或安慰剂治疗直至第16周(nemolizumab组,n=143;安慰剂组,n=72)。
2019年4月,该III期研究达到主要终点——治疗第16周视觉模拟量表(VAS)评分相对基线检查的变化率,nemolizumab组为-42.8%,安慰剂组为-21.4%,差异具有统计学意义。此外,该研究还达到多个次要终点:早在首次用药后第2天就报告了从基线检查到给药后4周的每日瘙痒VAS评分降低百分比(nemolizumab组,-10.3%;安慰剂组,-4.4%)。在第16周,nemolizumab组的湿疹面积及严重程度指数(EASI)评分变化百分比为-45.9%,安慰剂组为-33.2%。皮肤科生活质量指数(DLQI)评分≤4的患者百分比,nemolizumab组为40%,安慰剂组为22%。失眠严重程度指数(ISI)评分≤7分的患者百分比,nemolizumab组为55%,安慰剂组为21%。
此外,nemolizumab还被开发用于治疗中重度结节性痒疹(PN),且被FDA授予治疗PN相关瘙痒的突破性药物资格。其治疗中重度PN成人患者的随机、双盲、安慰剂对照、平行组、多中心、12周II期研究(NCT03181503)结果显示:从基线至第4周,与安慰剂组相比,nemolizumab治疗组峰值瘙痒数值评定量表(PP-NRS)评分相对基线显著降低。2个组基线PP-NRS评分为8.4分。在第4周,nemolizumab治疗组PP-NRS评分相比基线降低4.5分(变化:-53.0%),安慰剂组降低1.7分(变化:-20.2%),数据具有统计学显著差异(差异:-32.8%;95%CI:-46.8至-18.8,p<0.001)。而且,在所有其他指标方面,nemolizumab治疗组均显示出显著差异。在第18周(最后一次给药后10周),nemolizumab治疗组有38%的患者完全清除或几乎完全清除PN,安慰剂组为6%(p=0.001)。目前,该研究结果已发表在《新英格兰医学杂志》上。
特应性皮炎(AD)是一种常见的慢性炎症性皮肤疾病,以反复发作的剧烈瘙痒和皮疹为主要临床表现,是目前非致命性疾病中疾病负担第一的皮肤病。据WHO数据目前全球至少有2.5亿人受到AD困扰,通常始于儿童期,影响全球15-20%的儿童和1%-3%的成人。著名分析机构Global Data预测AD市场将以11.1%的年复合增长率在2027年突破170亿美元。
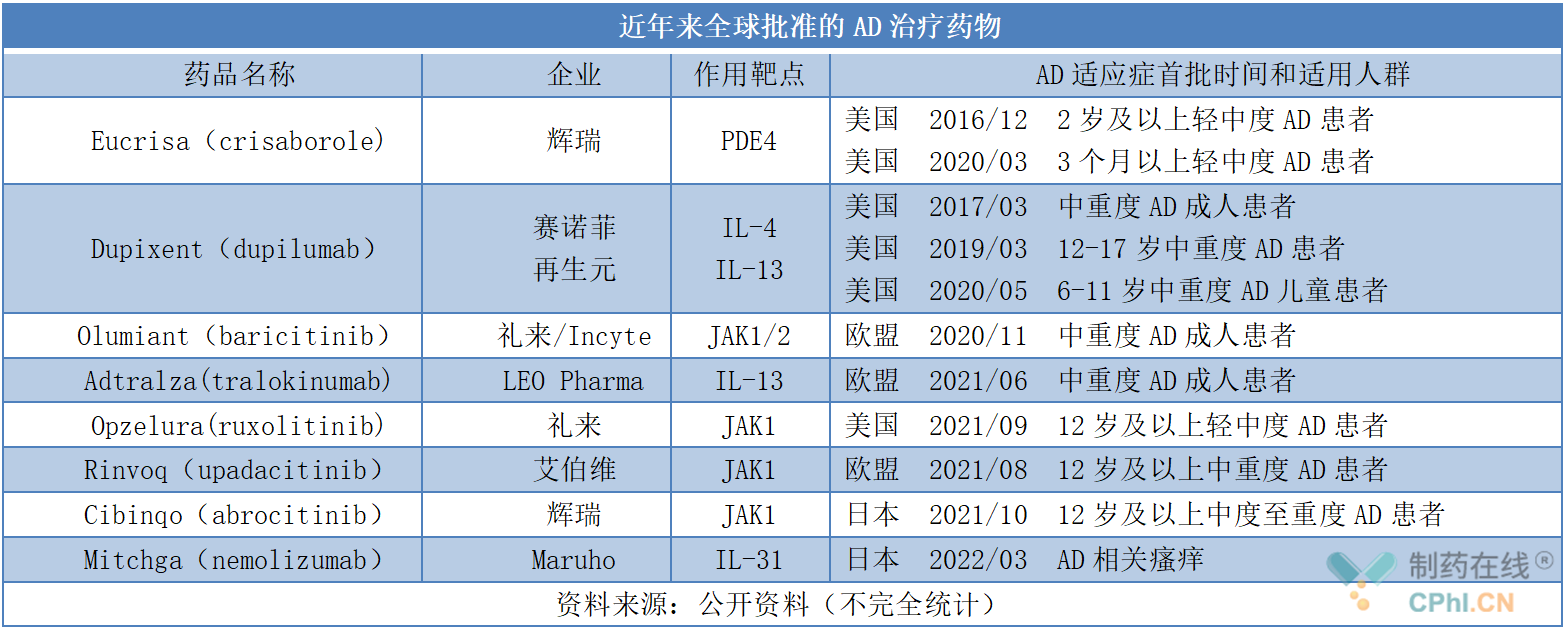
据不完全统计,近年来全球已批准多款AD药物(详见下表),药物类型涉及磷酸二酯酶4(PDE4)抑制剂、JAK抑制剂以及IL-4/IL-13、IL-31。此外,康乃德生物医药IL-4Rα靶向单抗CBP-201、ASLAN Pharma公司IL-13Rα1靶向单抗eblasakimab等药物也被开发用于治疗AD。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57