https://www.cphi.cn 2024-04-17 12:14 来源:CPHI制药在线 作者:江湖之远
近日,Adaptimmune Therapeutics宣布其在研工程化T细胞疗法afami-cel的关键性2期临床研究SPEARHEAD-1的积极数据发表于《柳叶刀》当中。美国FDA已接受afami-cel的生物制品许可申请(BLA),并授予其优先审评资格。该申请的PDUFA日期为2024年8月4日。如果获得批准,afami-cel将成为首 款用于治疗实体瘤的工程化T细胞疗法,也是十多年来治疗滑膜肉瘤的第一个有效疗法。

图片来源:参考来源1
共有52名患者在北美和欧洲的23个医疗中心参与了这项2期临床试验,其中44名滑膜肉瘤患者和8名黏液样圆细胞脂肪肉瘤(MRCLS)患者。36%的患者(19/52人)对治疗有反应,肿瘤缩小或在某些情况下完全消失。该疗法对滑膜肉瘤患者比对MRCLS患者更有效。平均而言,滑膜肉瘤患者的反应持续时间略高于11个月,而MRCLS患者的反应持续时间略高于4个月。大多数患者在癌症缓解一段时间后复发。目前为止,有少数在初始治疗后肿瘤消失的患者没有复发。
在所有患者中,平均生存期略高于15个月,一年生存率为60%。在滑膜肉瘤患者中,肿瘤对初始治疗显示完全应答(即单次治疗后肿瘤完全消失),一年生存率为90%,两年生存概率为70%。
该治疗最常见的副作用涉及红细胞和白细胞计数低,这是由于为准备身体接受工程T细胞所需的化疗所致。许多患者需要通过治疗来控制细胞因子释放综合征(即细胞因子风暴),这是T细胞疗法常见的副作用。在随访期间发生的28例死亡被证明均是由于癌症最终进展而非治疗所致。
在这项国际性、开放标签的2期临床试验中,TCR-T细胞疗法afami-cel在晚期滑膜肉瘤和黏液样圆细胞脂肪肉瘤(MRCLS)患者中产生了持久缓解。这项临床试验表明,TCR-T细胞疗法可以有效地靶向实体瘤,并为将这种方法扩展到其他实体恶性肿瘤提供了理论基础。
Afami-cel是一款MAGE-A4靶向的TCR-T细胞疗法,MAGE-A4作为癌睾丸抗原,在多种肿瘤组织中高表达。尽管滑膜肉瘤和黏液样圆细胞脂肪肉瘤是两种不同的癌症,但它们具有共同的临床和生物学特征,它们都高表达癌-睾丸抗原(CT抗原),包括MAGE-A4和NY-ESO-1。该疗法从患者体内提取T细胞并使用慢病毒载体进行基因工程改造,表达靶向HLA-A*02呈递的MAGE-A4 230-239 GVYDGREHTV的高亲和力和特异性T细胞受体(TCR),该TCR引导T细胞靶向表达MAGE-A4的癌细胞并清除这些癌细胞。FDA已授予其治疗晚期软组织肉瘤的孤儿药资格(ODD)和晚期滑膜肉瘤的再生医学高级疗法(RMAT)资格。
另外,Adaptimmune 还在开发下一代TCR-T疗法ADP-A2M4CD8,这种疗法与afami-cel的区别在于,这些细胞还表达CD8α共受体以及靶向MAGE-A4的工程TCR。其临床前数据表明,CD8α的共表达可以拓宽对实体瘤的免疫反应,并通过将CD4细胞转化为CD8杀伤细胞或细胞毒性T细胞来增加抗肿瘤活性,同时保留其CD4辅助功能;此外ADP-A2M4CD8针对MAGE-A4,MAGE-A4是在多种实体瘤类型中表达的癌症评估抗原的MAGE家族成员。目前A2M4CD8的1期SURPASS临床数据显示,疗效信号支持卵巢癌、尿路上皮癌和头颈癌的进一步发展。对于患有广泛表达MAGE-A4的不可切除或转移性肿瘤的患者(包括接受纳武利尤单抗(nivolumab)联合治疗的患者),ADP-A2M4CD8继续显示出可接受的风险效益。
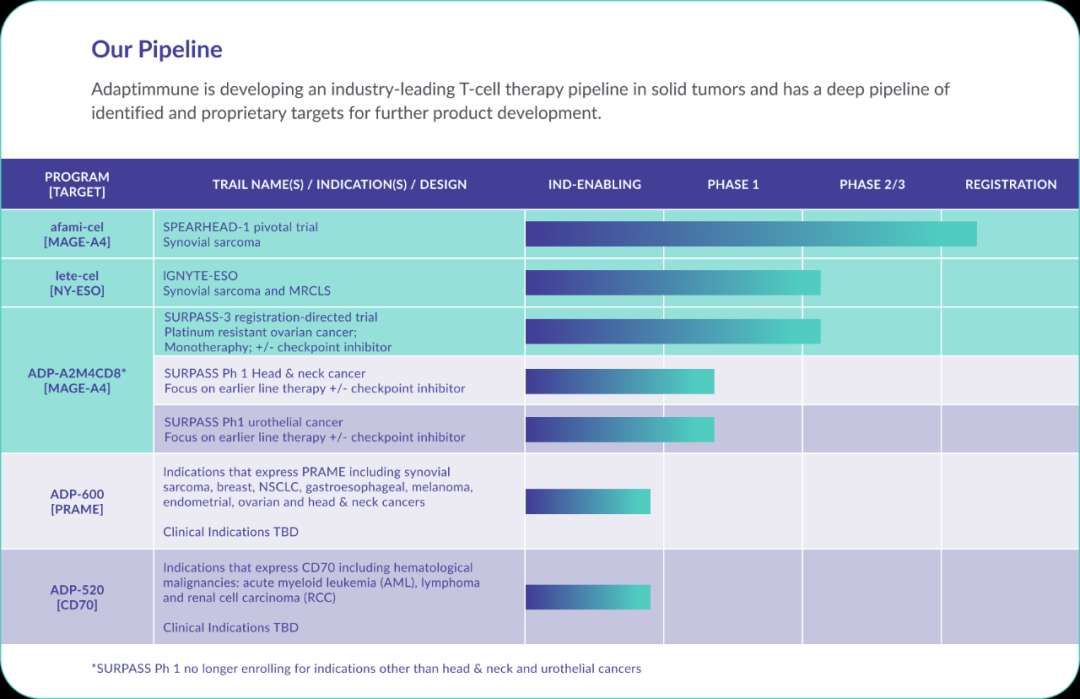
Adaptimmune临床实体瘤T细胞治疗管线
图片来源:Adaptimmune官网
喜中有忧的Adaptimmune
Adaptimmune Therapeutics是一家细胞疗法公司,致力于重新定义癌症治疗方法,尤其聚焦实体瘤治疗。公司独特的工程化T细胞受体(TCR)平台使T细胞工程能够靶向摧毁多种实体瘤类型的癌症。2023年3月,Adaptimmune和TCR2 Therapeutics共同宣布,两家公司将合并成为一家新公司,进一步巩固了Adaptimmune公司在TCR-T细胞疗法领域的地位。
Adaptimmune依托其独有的Spear-T细胞技术,是最早将TCR-T疗法推进临床试验的Biotech公司。Adaptimmune的技术曾先后得到葛兰素史克、安斯泰来、基因泰克等大药企的认可,建立了合作开发的关系,但遗憾的是,最后都无疾而终了。
• 2022年10月, 葛兰素史克向Adaptimmune退还了靶向NY-ESO的TCR-T疗法的全部权益;
• 2023年4月,安斯泰来宣布终止了与 Adaptimmune的TCR-T疗法研发合作,此前该合作项目总金额达8.975亿美元;
• 2024年4月,基因泰克宣布终止了与Adaptimmune公司价值高达30亿美元的细胞疗法合作。两家公司最初计划开发针对最多五个癌症靶点的异体细胞疗法,同时建立一个个性化异体细胞疗法平台。
除了与多个MNC的合作项目告吹外,Adaptimmune公司的股价在过去两年的跌幅较大还有其他原因:
• 研发进度慢。主要资产afami-cel在递交上市进度方面较为拖拉,此前给出的预期是2021年上半年申报BLA,2022年上市,目前进度已经大为落后。
• 临床试验数据存在瑕疵。afami-cel此前发布的数据中,药物疗效的持久性存疑,入组患者中存在细胞因子释放综合征的现象,加剧了市场对药物能否获批的担忧。
• 适应症市场想象空间不足。滑膜肉瘤的发病率为2.75人/10万人,全美每年新增病例不足800人,作为一款二线疗法,afami-cel的销售潜力难以突破1亿美元。
TCR-T疗法简介
TCR-T的全称是"T细胞受体工程化T细胞疗法",同属新型细胞免疫疗法。主要通过基因编辑技术,将能特异性识别肿瘤抗原的T细胞受体(TCR)基因导入患者自身的T细胞内,使其表达外源性TCR,从而具有特异性杀伤肿瘤细胞的活性。
T淋巴细胞被誉为人体内的"战士",在人体血液、淋巴和周围组织器官发挥免疫功能,能够抵御和消灭肿瘤细胞。但在肿瘤细胞逃逸过程中,T细胞却不能很好地识别杀伤肿瘤细胞。
TCR(T cell receptor)是T细胞表面的特异性受体,以非共价键与CD3结合,形成TCR-CD3复合物,通过识别并结合MHC呈递的抗原从而激活T细胞,促进T细胞的分裂与分化。TCR-T疗法是向正常外周血淋巴细胞上导入已知的抗原特异性TCR基因进行治疗的一种疗法。普通T细胞中引入新的基因,使得改造过的T细胞能够表达有效识别肿瘤细胞的TCR,从而引导T细胞杀死肿瘤细胞。
目前在血液瘤领域大获成功的CAR-T,由于特异性靶标的掣肘,在实体瘤领域进展缓慢。而TCR-T识别的是多肽-MHC复合体,不仅精准、范围广泛,还更容易浸润到实体瘤内部,大大拓宽了肿瘤免疫治疗的靶点。针对单个抗原靶点的TCR-T回输后,可以进一步激活患者自身针对其他肿瘤抗原表位的T细胞,具有逆转实体瘤抑制性免疫微环境的作用,有望实现更好的疗效与持久性。与此同时,TCR-T只介导少量细胞因子的释放,在安全性上具有天然优势。总体而言,TCR-T将是实体瘤治疗领域极具威力的"杀手锏"
国内药企争相布局TCR-T赛道
TCR-T 研发的星星之火,已渐成燎原之态,国内外众多企业布局 TCR-T 细胞治疗。2022 年 1 月,美国食品和药物管理局(FDA)已批准全球第一个 T 细胞受体(TCR)治疗药 Kimmtrak(IMCgp100)上市,用于治疗 HLA-A*02:01 阳性不可切除性或转移性葡萄膜黑色素瘤(mUM)成人患者,为TCR 疗法治疗实体瘤奠定基础。而今第一个 TCR-T 疗法的申报上市,意味着肿瘤治疗靶点从胞外转移到胞内,开辟了全新的靶点选择空间。
根据美国临床试验注册库的数据,目前在研的 TCR-T 治疗实体瘤种类,主要包括转移性非小细胞肺癌、肝细胞癌、多发性骨髓瘤、软组织肉瘤、头颈癌、黑色素瘤、脂肪肉瘤和宫颈癌等,主要分布在美国和中国。在国内的 TCR-T 细胞治疗中,香雪制药、百吉生物、天科雅、普瑞金、深圳宾德、来恩生物、泛恩生物、华夏英泰、立凌生物、可瑞生物等多家药企布局了这一赛道。
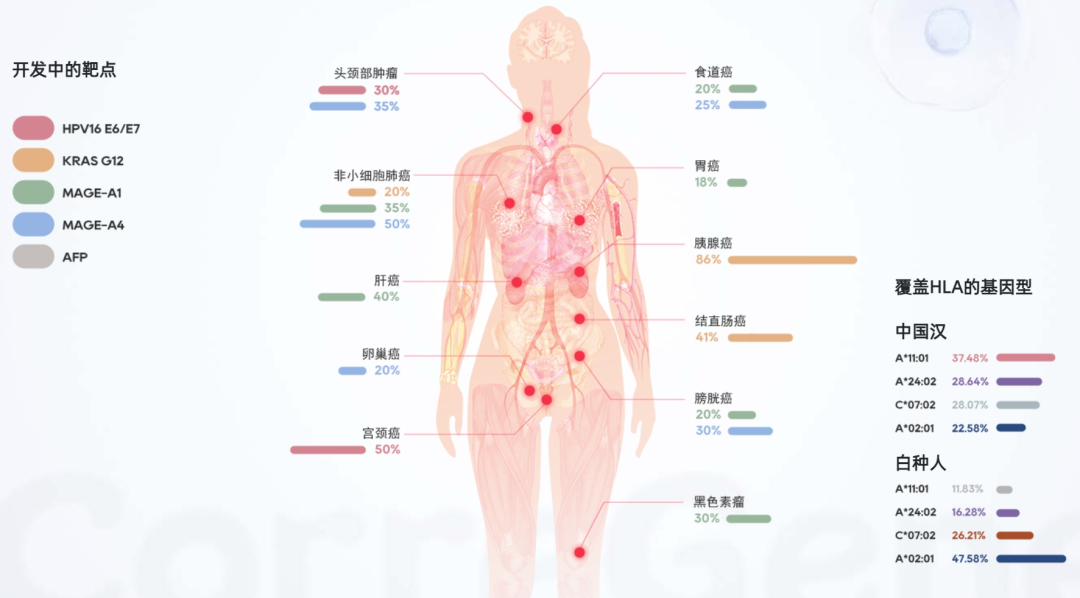
TCR-T疗法覆盖的肿瘤适应症
图片来源:可瑞生物官网
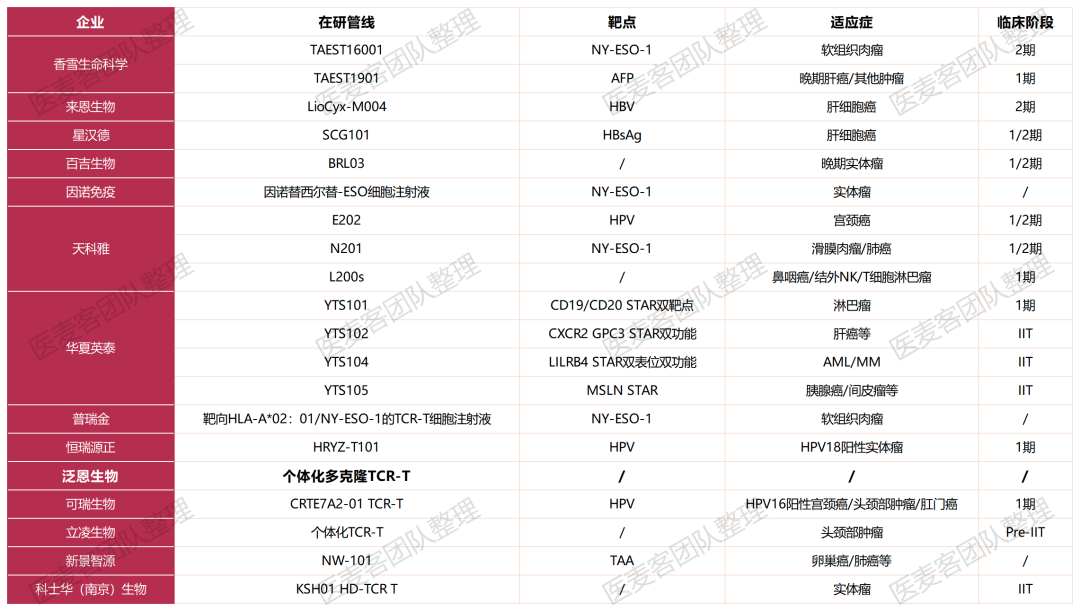
国内 TCR-T 细胞治疗企业与管线一览(部分)
图片来源:医麦客
香雪制药的TAEST16001是中国首 个获批临床试验的TCR-T细胞疗法。2023年8月15日,国际著名期刊Cell Reports Medicine刊发了TAEST16001的1期临床研究成果,该产品适应症为软组织肉瘤,I期临床研究肿瘤客观缓解率(ORR)达到41.7%,中位无进展生存期(PFS)为7.2个月,中位缓解持续时间(DOR)为13.1个月,并已进入II期临床研究。
来恩生物的First in class候选TCR-T疗法LioCyx-M004能够利用mRNA编码表达HBV抗原特异性的TCR来靶向肝癌细胞。2022年11月,来恩生物在2022年美国肝病研究协会年会上以海报形式公布了LioCyx-M004的1期临床试验数据,初步证明了该产品具有良好的靶向性和持久抗肿瘤作用。目前,LioCyx-M004正在进行2期临床试验。
星汉德生物的SCG101通过引入病毒特异性TCR基因序列重定向T细胞,使其表达针对乙肝病毒表面抗原(HBsAg)的特异性T细胞受体,定向清除HBV感染的肝细胞和肝癌细胞,还可能调节肝脏中的免疫抑制微环境。值得一提的是,这是第一个在中国获批IND治疗肝癌的TCR-T细胞治疗药物。去年6月,星汉德生物在国际细胞与基因治疗学会(ISCT)会议上展示了SCG101的最新临床数据:单剂量SCG101输注后可根除100%的HBsAg+肝细胞,使得74.5%的肝肿瘤细胞减少。
天科雅的TC-E202是一种加载抗PD-1抗体的TCR-T疗法,它在编码HPV16 E6 TCR的同时,编码抗PD-1的单链抗体可变区片段。经病毒转染,T细胞能够表达HPV16 E6 TCR并同时分泌抗PD-1的单链抗体,有效消除肿瘤微环境的抑制。当TC-E202输入患者体内,经改造的T细胞表面表达的TCR能有效识别宫颈癌肿瘤抗原HPV16 E6。目前TC-E202正在开展I/II期临床研究,旨在评估TC-E202在HPV16阳性的既往治疗失败的复发或转移性宫颈癌患者中的安全性和耐受性。
参考来源
1. Sandra P D'Angelo,et al. Afamitresgene autoleucel for advanced synovial sarcoma and myxoid round cell liposarcoma (SPEARHEAD-1): an international, open-label, phase 2 trial . doi.org/10.1016/S0140-6736(24)00319-2
2. 企业官网
3. Yating Liu, et al. TCR-T Immunotherapy: The Challenges and Solutions . Front Oncol. 2022 Jan 25;11:794183.
4. Estelle Baulu, et al. TCR-engineered T cell therapy in solid tumors: State of the art and perspectives. Sci Adv. 2023 Feb 15;9(7):eadf3700.
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030