https://www.cphi.cn 2024-05-03 18:18 来源:CPHI制药在线 作者:Krebs Qin
1. 肿瘤学加速批准替代终点的争议
FDA的加速批准计划允许根据替代终点而不是总生存率作为监管审批的凭据。总体生存率通常是肿瘤学的黄金标准,毕竟肿瘤学疗法的终 极目标是延长患者的生命。因此加速批准政策中引发广泛争论的一点就在于替代终点的合理性。
最近发表在《美国医学会杂志》上的一篇文章《接受加速批准的癌症药物的临床效益和监管结果》(Clinical Benefit and Regulatory Outcomes of Cancer Drugs Receiving Accelerated Approval)声称,2013年至2017年获得加速批准的癌症药物中, 经过 5 年多的随访后,41% (19/46) 的患者在验证性试验中并未改善总体生存率或生活质量,另外 15% 的患者尚未获得这方面的结果。
2. 加速批准风险收益比
依照替代终点作为标准对加速批准项目进行审批,其风险收益比究竟如何?
首先,通过加速审批上市的药物,并非全部缺乏临床益处,很多药物通过了上市后验证性研究并最终升级为全面批准。不可否认的是,获得加速批准药物至少针对替代终点获得了成功,但它们并不一定优于当前的护理标准。而且值得注意的是,将加速批准转变为全面批准通常是基于总体生存获益方面的数据。
4月22日发表在Journal of the National Comprehensive Cancer Network上的一篇文章检查了截至 2022 年 12 月通过加速批准途径上市的 69 种肿瘤疗法,这些疗法获得了总体生存率的数据。这些适应症涵盖罕见且快速进展的晚期癌症,例如中位总生存期为 16 个月且预期寿命延长 6 个月的持续性、复发性或转移性宫颈癌。
该研究的主要发现包括:
• 分析估计,从 2006 年到 2022 年,在可获得总体生存数据的 69 种加速批准产品中,约 91.1万名癌症患者的生命年增加了约 26.3万年。如果这个时间表延长到 2026 年,额外的生命年将增加到 38.2万年(图1)。
• 在亚组分析中,接受孤儿药指定产品治疗的 264061 人生命年延长了 145413 年,比标准治疗延长了 16.5%。
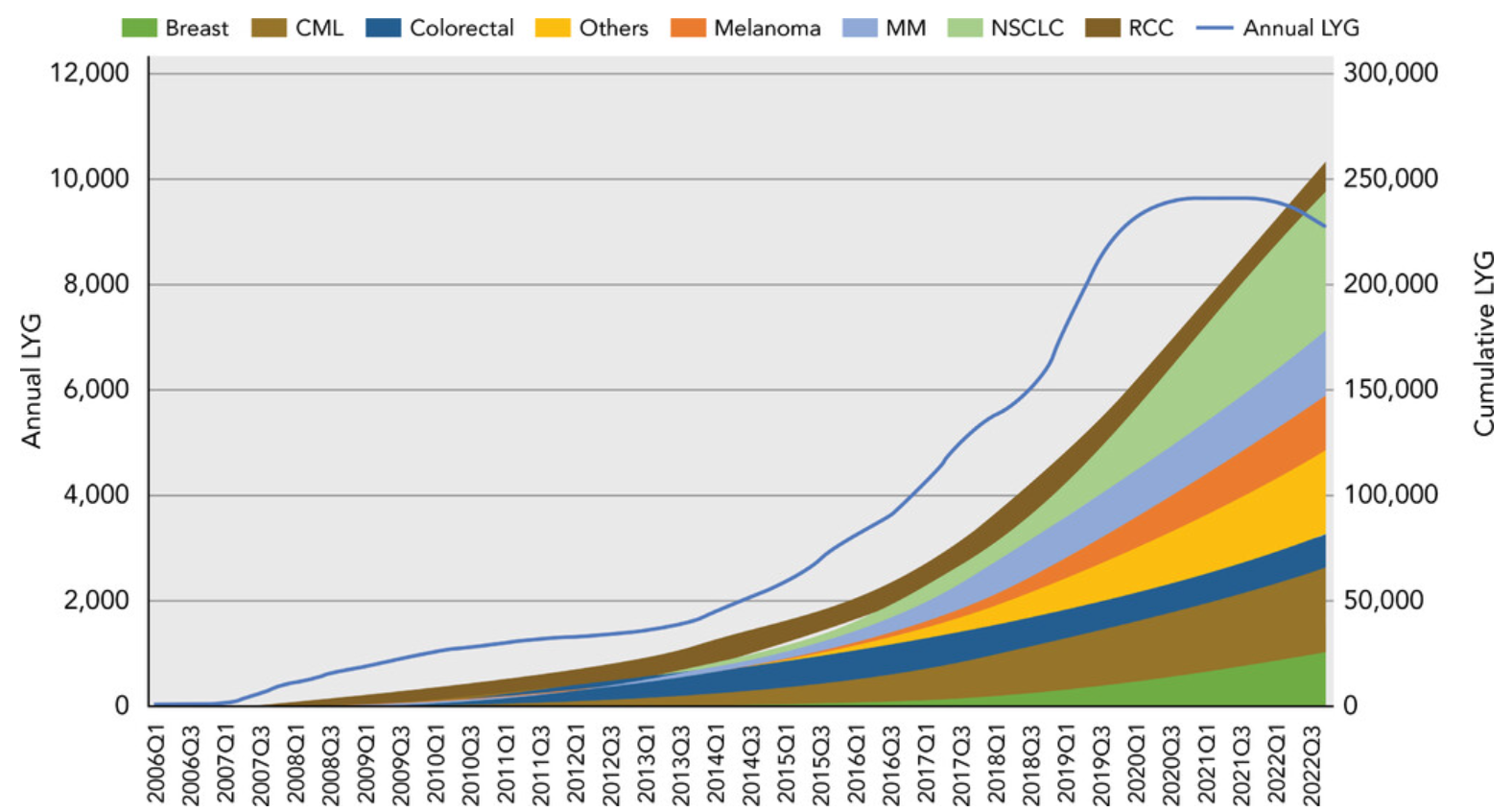
图1. 按癌症类型划分的年度和累积 LYG (life years gained,增加生命年)。CML,慢性粒细胞白血病; LYG,获得的生命年; MM,多发性骨髓瘤; NSCLC,非小细胞肺癌; RCC,肾细胞癌。(图片来源:Journal of the National Comprehensive Cancer Network)
3. 失败的加速批准,问题出在加速批准本身吗?
Journal of the National Comprehensive Cancer Network的这篇文章表明,加速批准并非完 美的,这是众所周知的事实,一些通过加速批准途径上市的药物确实在验证性试验中失败了。但需要强调的是,这是产品的失败,而不应该被看做流程的失败,只能说流程可能存在缺陷。
首先要强调的是,癌症的加速批准并不可以过度地"由此及彼"地推广到其它罕见疾病和一些常见疾病,例如已经成功确定生物标志物的乙型肝炎。
除此之外,很难预测哪种加速批准疗法将产生优于现有的一线疗法。现实世界证据在加速批准后的验证性研究中发挥着关键作用,但这并不意味着这个过程会更加耗时,只是说上市后验证性研究与传统的随机对照试验(RCT)有所不同。
当一种用于治疗严重疾病的药物预计比现有治疗方法具有优势时,根据美国法律可以使用加速批准途径。数据必须始终是 FDA 每项决策的基础,但数据并不总是黑白分明的。就像很多研究中,统计学给出的p值表明治疗组相对于对照组具有统计显著性,但未必能获得FDA的批准,因为可能不具备临床显著性。因此FDA在审视加速批准项目的数据时,有时会出现模棱两可的情况,就像当初加速批准杜氏肌营养不良症基因疗法Elevidys时那样,会在晦涩不明的数据面前衡量风险收益比,从而做出是否进行加速批准的决定。
但正所谓"不审势即宽严皆误",FDA面对着的是对治疗疾病望眼欲穿的患者群体和他们背后的患者权益组织。为此FDA推出了以患者为中心的药物开发 (PFDD,Patient-focused drug development) 策略,确保捕获患者的经验、观点、需求和优先事项,将其纳入药物开发和评估中。患者的声音可以帮助FDA了解药物开发和评估的治疗背景。
从以患者为中心的药物开发计划中汲取的一个重要教训是,患者往往愿意接受更高的风险换来利益,而这些利益在审评者来看却只是次要的好处。
如何让尽可能有效的药物最快地抵达患者手中,是加速批准的核心要义。一项研究发现,依靠加速批准上市的癌症治疗比传统批准的时间平均早三到四年。 例如礼来的胸膜间皮瘤和非小细胞肺癌药物Alimta®(pemetrexed)加速批准使得超过 900 万人提前获得药物。 从这一角度来看,加速批准符合了30年前制定策略时的初衷。
4. FDA加速批准指南与替代终点的修正
2023年3月24日, FDA发布了加速批准肿瘤药物的临床试验设计指南草案,允许单臂试验和客观反应率(ORR, objective response rate)作为替代终点,并且有可能仍然使用PFS作为将加速批准升级为全面批准的依据。该指南草案指出,那些基于单臂试验获得加速批准的肿瘤学疗法,FDA可能要求上市后试验来评估PFS或总体生存率,并且可能需要单独的随机对照试验。包括NBCC(National Brest Cancer Coalation)在内的组织已经对于使用ORR和PFS替代终点证明临床效应的做法表示了反对。
另一方面,FDA的举动还透露出修正替代终点的意图。在2024年4月12日召开的FDA肿瘤药物咨询委员会会议上,微小残留病 (MRD,minimal residual disease) 被一致认为是恰当的支持多发性骨髓瘤治疗药物加速批准的新型终点。微小残留病是指在治疗结束后,经过常规检测方法无法检测到的极微小的癌细胞或异常细胞。在癌症治疗中,常规的临床检查可能无法检测到微小残留病,但通过更敏感的检测方法,如分子生物学技术或流式细胞术,可以检测到极少量的残留癌细胞。微小残留病的存在可能暗示着患者可能在未来复发,因此对于评估治疗效果和预测患者预后至关重要。肿瘤药物委员会认为,如果未来发现MRD并不可靠地预测疾病进展或患者生存,那么先前基于MRD作为终点所做的加速批准可以被取消。MRD未来作为多发性骨髓瘤新的替代终点,也就意味着FDA有可能将淘汰ORR作为这一适应症加速批准的替代终点。肿瘤药物咨询委员会还讨论了 MRD 评估的敏感性,专家一致认为 10-5 阈值是合适的。
很显然,尽管行业认可加速批准的动机,但针对试验设计、终点选择和审评标准的争议,恐怕仍然要持续很长的时间。与此同时,FDA也逐渐认识到了加速批准可能带来的弊端,并且正在通过寻求新的法案和监管规定来不断修正失误,并且优化加速批准的风险利益比。未来肯定还会出现加速批准但最终被证明为无效的药物,但非战之罪。
Ref.
Liu, I, T. T. et al. Clinical Benefit and Regulatory Outcomes of Cancer Drugs Receiving Accelerated Approval. JAMA. Published online April 07, 2024. doi:10.1001/jama.2024.2396
Benedict, A. et al. Life Years Gained From the FDA Accelerated Approval Program in Oncology: A Portfolio Model. Journal of the National Comprehensive Cancer Network. 22. 04. 2024.
CDER Patient-Focused Drug Development. FDA. 14. 02. 2024.
Oncology Drug Development in Focus: FDA Offers Recommendations for Clinical Trial Designs to Support Accelerated Approval. Ropes & Gray. 29. 03. 2023.
Clinical Trial Considerations to Support Accelerated Approval of Oncology Therapeutics. FDA. 24. 03. 2024.
FDA Guidance on Accelerated Approval Trial Design for Oncology Drugs Falls Short. NBCC. 02 .0 6. 2023.
Pitts, P. J. et al. Bashing accelerated approval isn't supported by the data. STAT. 23. 04. 2024.
Silverman, B. Minimal Residual Disease Gains Max US FDA AdComm Support For Myeloma Trials. Pink Sheet. 12. 04. 2024.
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030