https://www.cphi.cn 2024-02-23 16:38 来源:CPHI制药在线 作者:忆
甲状腺眼病(TED),又称Graves眼病,是与甲状腺疾病密切相关的一种器官特异自身免疫性疾病,位居成人眼眶疾病发病率首位。TED是Graves病主要的甲状腺外表现,可引起眼睑退缩、眼球突出、复视、限制性斜视、暴露性角膜病变和视神经病变,严重影响患者生活质量。
TED发病机制还不完全明确,可能与免疫、遗传和环境等因素有关。研究发现,细胞免疫(Th1、Th2、Th17、Treg细胞等)、体液免疫(自身抗体)、眼眶成纤维细胞(OF)均参与了TED的发生和发展,其中OF被认为是关键的效应细胞,在TED发病机制中起核心作用。
治疗上,TED根据严重程度采取不同的治疗措施。国内外指南明确推荐,对于轻度TED给予局部治疗、补硒或生活方式干预,对于中重度和极重度活动期TED首选糖皮质激素静脉冲击治疗。糖皮质激素只能改善TED症状,不能从根本上改善TED。
Teprotumumab:第一个TED靶向治疗药,已进入重磅行列
2020年TED治疗取得重大进展,迎来第一个靶向治疗药物Teprotumumab(替妥木单抗,Tepezza)。该药是一种人源单克隆抗体,可抑制活动期和非活动期TED患者眼眶成纤维细胞(OFs)表面IGF -1R的信号传递,从而减轻炎症反应和眼眶组织的体积。国外数项临床研究显示:Teprotumumab治疗能有效的改善TED患者的症状和活动度,在减轻突眼方面具有显著的优势。2020年1月,Teprotumumab被FDA批准用于治疗成人TED眼病。
不过,Teprotumumab的价格让很多患者望而却步,据悉其售价为14900美元/瓶,6个月治疗费用高达35万美元。但Teprotumumab市场表现还不错,2020年至2022年销售额分别为8.2亿美元、16.6亿美元和19.66亿美元。
TED在研药物进展,IBI311即将申请上市
除了Teprotumumab,目前全球还有多款药物被开发用于治疗TED,详见下表。整体来看,在研TED药物靶点相对集中,主要为IGF -1R。从研发进度上看,若进展顺利,TED领域未来几年将迎来新的治疗药物。
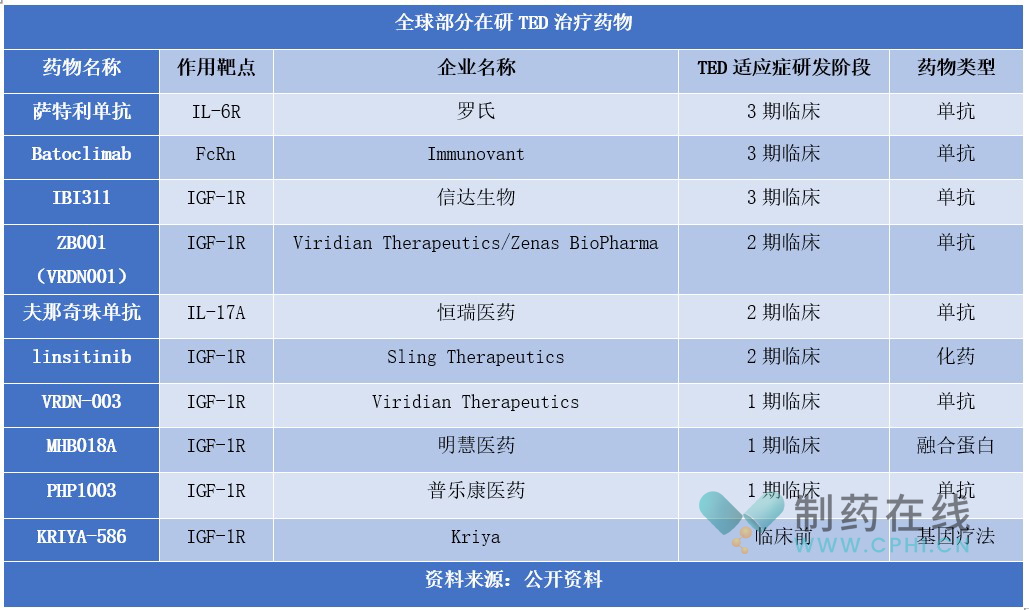
具体品种上看,萨特利单抗、Batoclimab和IBI311进展较快,处于3期临床,其中信达生物的IBI311有望最快出线。
IBI311是信达生物研发的重组抗IGF -1R抗体,可阻断IGF -1等相关配体或激动型抗体介导的IGF -1R信号通路激活,减少下游炎症因子的表达,从而抑制OFs活化导致的透明质酸和其他糖胺聚糖合成,减轻炎症反应。而且,IBI311还抑制OFs分化为脂肪细胞或肌成纤维细胞,进而减轻TED患者的疾病活动度,改善突眼、复视、眼部充血水肿等症状和体征。
近日,信达生物宣布IBI311在中国TED受试者中开展的3期注册临床研究(RESTORE-1)达成主要终点:第24周时,接受IBI311治疗的受试者研究眼的眼球突出应答率显著优于安慰剂组(85.8% Vs 3.8%)。此外,该研究的关键次要研究终点如研究眼的眼球总体应答率(研究眼相对于基线突眼度回退≥2mm及研究眼临床活动性评分改善≥2分的受试者比例)、研究眼临床活动性评分(CAS)为0或1的受试者百分比、研究眼的眼球突出度较基线的改变等均顺利达成。而且,IBI311安全性良好,研究中未发生严重不良事件。
基于上述研究结果,信达生物计划近期向CDE递交IBI311治疗TED的上市申请。
萨特利珠单抗是罗氏开发的一款IL-6R靶向单抗,2020年8月被FDA批准用于治疗视神经脊髓炎谱系疾病(NMOSD)成人患者。2023年9月,该药在国内启动针对TED的3期临床试验。
Batoclimab是一款针对新生儿片段可结晶受体(FcRn)的新型全人单克隆抗体,通过降低TED患者体内病理性IgG 水平,减轻成纤维细胞活化而达到临床疗效。2022年第四季度,Immunovant启动Batoclimab治疗TED的3期临床计划。
ZB001、夫那奇珠单抗和linsitinib处于2期临床。其中ZB001是Viridian Therapeutics开发的一种抗IGF -1R单克隆抗体,可以通过亚纳摩尔级别的亲和力结合和阻断IGF -1R信号通路。
已公布的1/2期临床试验结果显示:3 mg/kg和10 mg/kg剂量的VRDN-001均能使慢性TED患者的眼球突出程度和临床活动评分(CAS)在第6周得到快速且有临床意义的改善。而且,VRDN-001在所有剂量下均显示出了良好的安全性。
2020年10月,Zenas BioPharma从Viridian Therapeutics获得在大中华区开发、生产和商业化ZB001以及其它针对IGF -1R药物用于治疗非肿瘤适应症的授权。
夫那奇珠单抗是恒瑞医药自主研发的人源化IgG1抗IL-17A单抗,与IL-17A结合后可抑制下游细胞因子,从而阻断炎症信号传导。目前,该药已先后在国内递交治疗斑块状银屑病和强直性脊柱炎的上市申请。目前,夫那奇珠单抗正在开展治疗成人活动性银屑病关节炎、成人活动性中重度TED等多种自身免疫性疾病的2期临床试验。
Linstinib是一种在研IGF -1R小分子抑制剂。临床前动物实验结果表明,免疫小鼠在发病后用linsitinib治疗,可显著限制疾病早期和晚期的严重程度。而且,linsitinib治疗还阻止了自身免疫反应的发展,包括自身免疫性甲状腺功能亢进、形态学变化、眼眶棕色脂肪组织的形成以及小鼠模型中TED所有阶段的眼眶免疫细胞浸润。
VRDN-003、MHB018A、PHP1003和KRIYA-586处于1期临床。其中VRDN-003是一种IGF -1R靶向单抗,其采用与VRDN-001相同的结合域,并且在设计中对Fc区进行了3个氨基酸优化,目的是延长抗体的半衰期。2023年12月,Viridian Therapeutics宣布VRDN-003的1期临床研究取得阳性数据:VRDN-003的半衰期可延长至40-50天,比VRDN-001延长约4-5倍。而且,VRDN-003耐受性良好,并表现出持续的药效学特性。这支持将VRDN-003开发为治疗TED患者的一种同类最 佳、更方便、频率更低、低剂量、自我给药的皮下IGF -1R疗法。
MHB018A是人源化单域IGF -1R抗体和人源Fc的新型融合蛋白,对IGF-3和 IGF-5的配体阻断活性是其他已知IGF -1R抗体的3~5倍。此外,该分子的溶解度为150 mg/ml,具有高浓度配方和良好稳定性,适用于皮下给药治疗TED。2023年5月,该药的1a期临床试验完成首例患者给药。
PHP1003是国内第一个自主研发、创新皮下注射给药方式、具备良好的稳定性的IGF -1R抗体药物剂型,2022年7月在国内获批临床。在临床前研究中,PHP1003显示出良好的安全性和依从性,开发的创新制剂能够实现家庭自主用药管理,且能够实现长期室温保存(传统抗体药物保存温度一般为2~8度)。
KRIYA-586是一种一次性腺相关病毒 (AAV) 基因治疗药物,可驱动阻断IGF -1R的单克隆抗体的持久表达。该疗法设计将在门诊通过眼周脂肪组织注射给药,驱使该组织中细胞局部表达分泌抗体,以阻断肌细胞、脂肪细胞和成纤维细胞上的IGF -1受体。
总结
作为一种自身免疫性疾病,目前TED获批的治疗药物极其有限。除了Teprotumumab被批准用于治疗TED,IL-6靶向药托珠单抗、CD20靶向药利妥昔单抗等生物制剂也被EUGOGO指南和中国甲状腺眼病临床诊断和治疗指南(2022年)和美国甲状腺学会和欧洲甲状腺学会的TED共识推荐为中重度活动性TED的二线治疗方案。
纵观在研TED治疗药物,其作用靶点主要为IGF -1R、IL-6、IL-7A、FcRn,尤其是IGF -1R。值得一提的是,全球第二款治疗TED的IGF -1R靶向药即将出线,IBI311治疗TED的3期临床试验已于近期取得积极结果,信达生物即将递交上市申请。期待TED领域早日迎来新的治疗药物,造福众多TED患者。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030