https://www.cphi.cn 2018-05-21 16:42 来源:CPhI制药在线 作者:Tumour
嵌合抗原受体(CAR)T细胞疗法是一种新型的过继免疫细胞疗法,其通过对病人T细胞的工程化改造,将独立的MHC特异性抗原受体与协同刺激分子融合在T细胞内外,跳过抗原处理和呈递过程,直接激活T细胞对癌症特异性抗原的免疫应答。
CARs由细胞外、跨膜和细胞内域三部分组成。细胞外域由一个单链可变片段(scFv)组成,它来自于抗体的轻和重链区域,作用是在不涉及MHC的情况下,与特定肿瘤相关抗原(TAA)结合。跨膜域也称为铰链域,由CD8和IgG4分子组成。它是细胞外和细胞内域之间的连接纽带。胞内域也被称为激活或信号域,由CD3ζ组成。在细胞内信号域的基础上,CAR受体有4代。CD3ζ是第一代的细胞内域。在接下来的几代中,为了增强T细胞的激活、增殖和持久性,添加了共同刺激分子如,CD27、CD28、4-1BB或OX-40。第二代由一种共刺激分子组成,第三代由两个共刺激分子组成。除了CD3ζ和共刺激分子,第四代还增加了抗肿瘤细胞因子基因(IL-12,IL-15),增强了工程化T细胞的抗肿瘤效应。
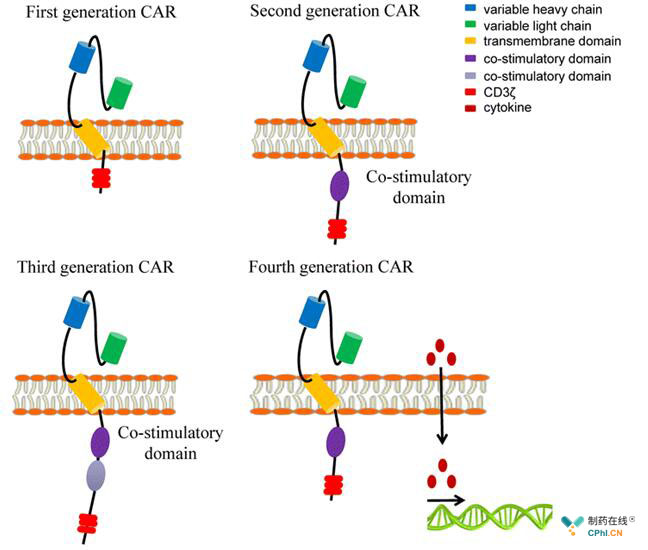
四代CAR-T原理图
目前,CAR-T疗法在血液恶性肿瘤中表现出了良好的效果,但却无法证明其在实体瘤中的价值。失败的原因有三,分别是:①缺乏合适的针对实体瘤的表面抗原;②肿瘤免疫逃逸机制影响CAR-T细胞在实体瘤中的浸润;③免疫抑制的肿瘤微环境降低了CAR-T细胞的功效。在此,我们将讨论采取哪些策略来增强CAR-T细胞疗法在实体瘤中的应用。
如何解决缺乏合适针对实体瘤的表面抗原的问题
策略1:靶向肿瘤突变抗原
EGFR是ErbB致癌基因家族成员之一,也表达在正常和肿瘤细胞表面。在许多癌症,如胰 腺 癌、头颈癌、结肠癌和乳腺癌中,EGFR均过表达,适合作为CAR-T细胞疗法的靶点。研究发现,敲出EGFR的6-273氨基酸形成的EGFRvIII,在脑癌中高表达,也是一种理想的靶点。类似地,另一个针对脑癌的靶点是IL13Rα2。它是仅仅表达于癌细胞,正常脑组织中不表达。在胶质母细胞瘤中过度表达,关于IL13Rα2的T细胞治疗正在进行中。
策略2:靶向多个肿瘤抗原
EGFRvIII CAR-T细胞疗法在胶质瘤病人表现出区域差异。IL13Rα2 CAR-T细胞疗法在治疗初期有应答反应,但随后由于对CAR-T的免疫抑制癌细胞又重新出现。为了解决这一问题,研究使用针对双靶点(EphA2 HER2 和IL13Rα2)的CAR-T细胞疗法表现出了良好的预临床效果。
策略3:对CAR-T细胞进行再修饰
从1代发展到4代,研究者一直在对CAR-T细胞近行不断修饰和改进。有一些T细胞激活的负调节蛋白如二酰基甘油(DAG)激酶,它有助于第二信使DAG的代谢和降解,来限制RAS的激活。针对这些调节剂和制造没有这些酶的CAR-T细胞,可以提高T细胞治疗在实体肿瘤中的功效。
策略4:筛选肿瘤过表达抗原
实体瘤的异质性是CAR-T细胞疗法在实体瘤中关键的限制因素。治疗过程中,细胞表面抗原异质性是肿瘤复发的主要原因之一。筛选出肿瘤表面抗原过表达的病人是解决这一问题的途径之一。针对高抗原表达的患者采用特定的CAR-T细胞进行治疗,可以减少肿瘤局部反应的机会,提高整体疗效。
策略5:双CAR系统
CAR-T细胞疗法的一个主要问题是找到理想的抗原,因为大多数抗原也由正常的身体细胞表达。因此,激活的T细胞,也会破坏正常的组织。为了避免这种复杂性,引入了双CAR的新概念。即工程化的T细胞包含两种CAR-T细胞,T细胞的激活将取决于这两中CAR-T细胞同时与它们的特定抗原结合。它将增加T细胞对肿瘤细胞的特异性,而正常组织则会减少与免疫相关的损害。最初,这些双CAR-T细胞甚至在呈现一种抗原时也表现出了溶解细胞反应,因为激活是如此强烈,以至于一种抗原能够引发免疫反应。后来,研究人员降低了CAR-T的亲和力,需要与CAR-T细胞结合的双肿瘤抗原来启动免疫应答。有了这个策略,我们就能控制免疫反应的亲和力,也能预防免疫相关的不良反应。双CAR系统FT819预临床数据在2018年AACR上大放异彩。
策略6:引入自杀基因
在正常组织中也存在目标抗原的情况下,抗肿瘤的效果就与免疫相关的**有关了,因为我们不希望正常的细胞受到伤害。这种**可以通过诱导自杀基因来预防。这些自杀基因会选择性地抑制CAR-T细胞,从而减少对邻近正常组织的伤害。目前在血液恶性肿瘤中有两种自杀基因,它们是诱导型caspase 9和单纯性疱疹胸苷激酶。这一策略将提高汽车T细胞治疗的疗效和临床反应。
如何解决肿瘤免疫逃逸机制对CAR-T细胞在实体瘤中浸润的影响
策略1:使CAR-T细胞上表达趋化因子受体
趋化因子由癌细胞分泌,有助于T细胞的移行至肿瘤部位。对于CAR-T细胞适当的迁移,CAR-T细胞受体应该是对趋化因子的补充。如果受体和趋化因子间存在不匹配,也会出现次优的细胞输送,从而导致临床反应不佳。因此,添加这些趋化因子基因将更好地迁移T细胞,改善临床反应。
策略2:利用溶瘤病毒提高趋化因子对CAR-T细胞的输送
在不影响正常细胞的情况下,溶瘤病毒有选择性地感染、复制和导致恶性细胞的溶解。因此,溶瘤病毒装备CCL5(也称为RANTES)和IL-15后,将起到趋化因子和生长因子的作用,有助于T细胞的迁移,并为T细胞的生长和生存创造一个细胞因子丰富的环境。与动物研究中的个别疗法相比,武装的溶瘤病毒和T细胞疗法联合使用,显示出了显著的效果。因此,研究人员将这两种特性结合起来,以改善CAR-T细胞的输送。另一个好处是,这些趋化因子仅在肿瘤细胞附近被检测到,而不是在血清中,因此没有系统性**。
策略3:HPSE-CAR-T细胞
T细胞会降解细胞外基质(ECM)和亚内皮基底膜,促进对肿瘤细胞的渗透。它们分泌特定的酶来实现这个功能,其中一个是乙酰肝素酶(HPSE),它能裂解HSPGs的硫酸乙酰肝素链。在CAR-T细胞工程化时,功能上的变化使它们无法分泌HPSE,从而减少了CAR-T细胞治疗的抗肿瘤效果。为了解决这个问题,研究人员开发了能够表达HPSE的工程T细胞。HPSE的CAR-T细胞疗法显示了更好的ECM降解效果,增强了T细胞的渗透,提高了抗癌效果。这一策略对改善实体肿瘤中T细胞治疗的效果是有益的。
策略4:CAR-T细胞的区域递送
对CAR-T疗法的主要担忧是系统的副作用,以及CAR-T细胞在癌症部位的不良递送。如果我们能直接在肿瘤部位运送T细胞,这些都可以得到处理。目前,对CAR-T细胞的区域传递进行了各种临床前和临床研究,已经得到了不多的结果。
改善肿瘤微环境提高CAR-T功能策略
策略1:PKA抑制CAR-T细胞疗法
PGE2是一种免疫抑制因子,它在肿瘤细胞上表达,通过抑制T细胞增殖和CD4辅助性T细胞功能来抑制免疫反应。PGE2与腺苷一起激活PKA,进一步抑制T细胞增殖。RIAD是一种肽,可以破坏PKA和埃兹蛋白之间的联系,解除PKA对T细胞激活的抑制。CAR-T-RIAD细胞疗法直接针对间皮素,提高了CAR-T细胞浸润,细胞因子释放,和抗肿瘤效果。
策略2:过氧化氢酶CAR-T细胞疗法
在实体瘤中,肿瘤微环境的炎症反应增加了ROS的产量,高剂量的ROS通过抑制免疫反应来帮助肿瘤生长和增殖。为了提高高氧化肿瘤微环境中CAR-T细胞的持久性,研究人员已经引进了表达过氧化氢酶的CAR-T细胞,减少肿瘤环境中氧化应激反应,为CAR-T细胞免受氧化损伤提供了保护,增强了抗肿瘤的效果。与此同时,它还为邻近的NK细胞提供了保护,进一步有助于降解癌细胞。
策略3:IDO抑制CAR-T细胞疗法
缺乏营养是实体瘤中CAR-T细胞治疗失败的一个主要原因。色氨酸是一种必需的氨基酸,由IDO代谢成免疫抑制代谢物,如3羟基蒽酸(3-HAA)和Kynurenine。在芳基烃受体(AHR)的帮助下,这种代谢物抑制T细胞增殖并导致T细胞的裂解。在淋巴瘤的体内研究中,在CD19-CAR-T治疗之前,给予氟达拉宾和环磷酰胺减少了IDO的表达,增强了抗肿瘤的效果。
策略4:抗纤维化细胞激活蛋白(FAP)CAR-T细胞疗法
与癌症相关的基质细胞(CASC)是癌症周围的正常基质细胞。它们分泌各种细胞因子、生长因子、趋化因子,帮助肿瘤扩散和转移。FAP是一种丝氨酸蛋白酶,它在上皮癌CASC中高度表达,并促进肿瘤发生。因此,CAR-T细胞疗法被设计成针对FAP。已经在动物实验中,促进CAR-T细胞效能方面取得了优异的成绩,在实体瘤中是一种有用的工具。
除此之外,其它的改善肿瘤微环境提高CAR-T功能策略包括CD40配体的CAR-T细胞、肿瘤生长因子β(TGFβ)负转基因CAR-T细胞、靶向细胞因子的CAR-T细胞和ICIs CAR-T细胞疗法等。CD40L同它的受体CD40结合,致使树突状细胞抗原呈递,细胞因子释放,免疫球蛋白的同型转换,激活B细胞。ICIs能改善肿瘤的微环境,解除肿瘤细胞对免疫细胞的免疫抑制。靶向细胞因子主要是解除某些细胞因子如IL-4和IL10的免疫抑制作用。这些新型CAR-T细胞疗法在预临床中均表现除了很好的疗效。
参考文献:
1. Jindal V, Arora E, Gupta S. Medical Oncology, 2018, 35(6): 87.
2. Wei G, Ding L, Wang J, et al. Experimental hematology & oncology, 2017, 6(1): 10.
作者简介:Tumour,食品科学与工程专业学士,国家三级公共营养师,生物化工专业硕士,目前为医药行业从业者,致力于癌症靶点及IRs抗体的研究开发,工作之余时刻关注医药行业动态和进展,同时从健康安全角度热切关注食品行业动态,为人类健康传播和提供科学的食品知识。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030