https://www.cphi.cn 2024-04-23 13:21 来源:药渡Daily 作者:木星
2024年2月22日,FDA批准了Allecra Therapeutics的抗生素复方头孢吡肟/恩美唑巴坦(Cefepime/Enmetazobactam,商品名:Exblifep)的上市申请,获批适应症为治疗由大肠杆菌、肺炎克雷伯菌、铜绿假单胞菌、奇异变形杆菌和阴沟肠杆菌复合体引起的18岁及以复杂性尿路感染(cUTI),包括肾盂肾炎。
关键3期临床试验ALLIUM研究
支持其获批的关键3期临床试验ALLIUM研究(试验编号:AT-301,登记号NCT03687255)是一项评估者单盲、哌拉西林/他唑巴坦主动对照、非劣效研究。受试者随机分为2组,分别接受头孢吡肟2g/恩美唑巴坦0.5g或哌拉西林4g/他唑巴坦0.5g,静脉输注2h,每8小时给药一次,疗程7天(若并发菌血症,则最多14天),且不允许转换为口服制剂。
有效性分析人群为mMITT人群,定义为接受任一试验药物的随机化人群,且尿培养基线至少一种G-病原体≥10^5CFU/ml或尿液和血压中的病原体对头孢吡肟恩美唑巴坦和哌拉西林他唑巴坦不耐药(MIC≤8/8μg/ml或MIC≤64/4μg/ml)。
主要终点为治疗结束后7天(test of cure)临床治愈和微生物学响应的复合终点,其中,临床治愈定义为筛查时基线的cUTI和肾盂肾炎的症状和体征完全消退(无新的尿路症状或新的恶化);微生物学响应定义为尿培养的基线定量的G-病原体降低至<10^3CFU/ml且鉴定为尿路病原体的G-病原体在血培养中阴性。主要终点的非劣效界值为95%置信区间下限>-10%;若达到非劣,则进行优效性评估且无需I类错误校正;若95%置信区间下限>0,则达到优效。
结果显示,头孢吡肟/恩美唑巴坦和哌拉西林/他唑巴坦总体成功率的复合终点分别为79.1% vs 58.1%,治疗差值为21.2%,95%CI下限为14.3%>0,达到了优效性标准;但两组临床治愈率无差异。
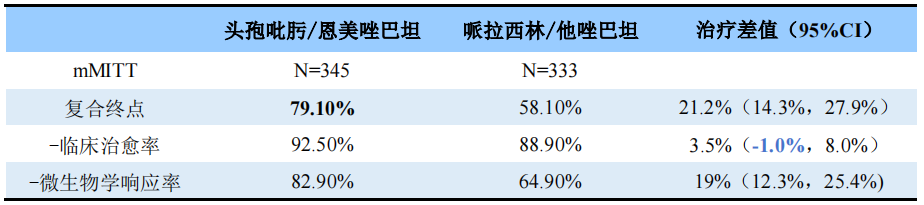
资料来源:EXBLIFEP FDA label
复杂性尿路感染(cUTI)可能与肾盂肾炎相关,通常需要住院治疗。此类患者治疗选择较为有限:
1)哌拉西林/他唑巴坦可作为cUTI经验性治疗,但并非cUTI或其他产ESBL阴沟肠杆菌复合体引起的严重感染的优选疗法;
2)碳青霉烯类抗生素虽然有效,但会导致耐碳青霉烯类菌株检出率上升。因此,需要更多非碳青霉烯类抗生素治疗手段。现有非碳青霉烯类抗生素有头孢他啶/阿维巴坦(Ceftazidime/Avibactam)、头孢洛扎/他唑巴坦(Ceftolozane/Tazobactam)和头孢地尔(Cefiderocol)。
头孢吡肟/恩美唑巴坦的优势在于对产ESBL的G-敏感菌株有效,对不同产ESBL菌株的MIC90在0.06~1μg/ml之间。头孢吡肟易受A类ESBL酶、A类和B类碳青霉烯酶水解,但对C类AmpC酶和D类OXA-48 β-内酰胺酶稳定;而恩美唑巴坦由他唑巴坦结构改造而来,对A类、C类、D类β-内酰胺酶均有抑制活性,可保护头孢吡肟不被ESBL酶水解失效。据美国CDC报告,2017年住院病人中有19.74万人感染了产ESBL的阴沟肠杆菌复合体,导致了约9100人死亡。然而,头孢吡肟/恩美唑巴坦也有劣势:首先,连续静脉输注7天并非临床常见做法;其次,ALLIUM研究中ESBL基因型检出率仅20.9%,表明无需联合使用β-内酰胺酶抑制剂。
在FDA获批后不久,2024年3月21日,EMA也批准了头孢吡肟/恩美唑巴坦用于以下人群:
1)治疗成人cUTI,包括肾盂肾炎;
2)治疗成人医院获得性肺炎(HAP),包括呼吸机相关肺炎(VAP);
3)治疗上述感染相关的或疑似相关的菌血症。
然而,Allecra Therapeutics并未进行过头孢吡肟/恩美唑巴坦治疗HAP/VAP的3期试验,为何EMA一口气批准了3个适应症?
事实上,Allecra Therapeutics仅完成了6项临床研究。

参考资料:Exblifep EMA Assessment Report
其中2项试验与申请适应症关系较大:
1)AT-301研究提供了有效性和安全性数据、患者PK数据以更新PopPK模型进行达标概率分析;
2)AT103研究提供了恩美唑巴坦在ELF的PK数据以支持治疗肺部感染。
而EMA曾指出:新的酶抑制剂与已获批的β-内酰胺抗抗生素组复方,可基于临床有效性,PK-PD合理性,志愿者中ELF中足够的药物分布来批准肺炎适应症。
但需要注意的是,获批剂量下的β-内酰胺类抗生素联合一个新的β内酰胺酶抑制剂的3期试验可能无法提供β-内酰胺酶抑制剂的单独有效性数据,因为没有严格要求此类试验限于对β-内酰胺类抗生素耐药、而对β-内酰胺类+β内酰胺酶抑制剂组合敏感的病原体引起的感染,因此,包含非临床PK/PD分析以及患者PK数据在内的PK/PD分析通常将作为支持β-内酰酶抑制剂的剂量确定的关键。
那么,恩美唑巴坦的剂量又是如何确定的?
1-非临床PK/PD分析
头孢吡肟是时间依赖性抗生素,PD指标为%fT>MIC(未结合药物浓度超过感染病原体的最小抑菌浓度的时间百分比)。文献报道60%fT>MIC与头孢菌素类最大杀菌效果相关,68%fT>MIC与G-菌血流感染最 佳生存机率相关,因此这2个PD靶值将用于达标概率分析。
①小鼠中空纤维感染模型:恩美唑巴坦保留头孢吡肟对ESBL阴沟肠杆菌复合体抗菌活性、抑制耐药的阈浓度(CT)是2μg/ml;
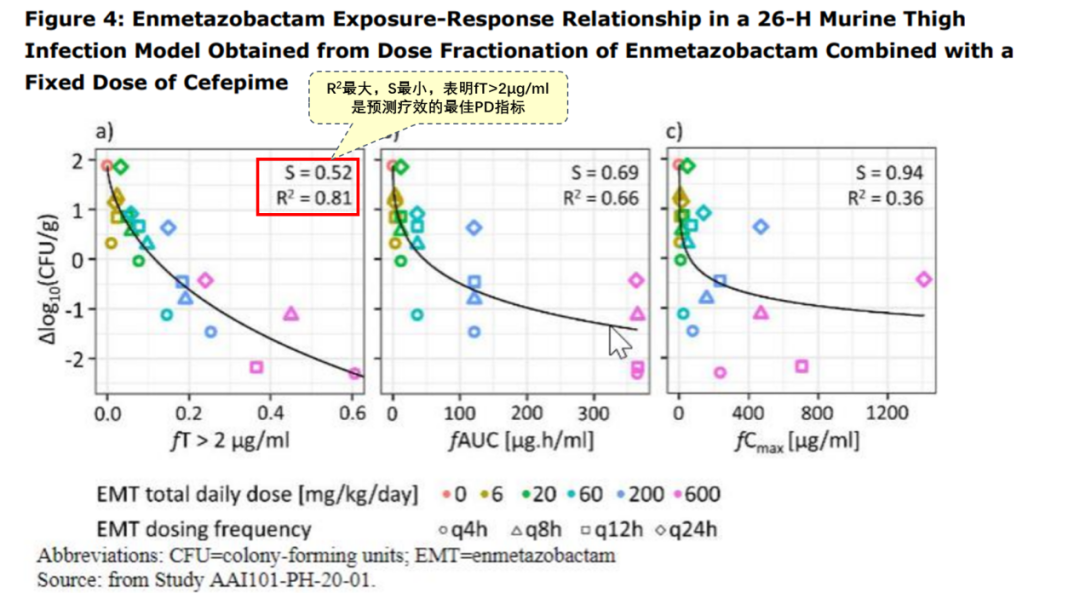
参考资料:Exblifep EMA Assessment Report
②中性细胞减少的小鼠大腿ESBL阴沟肠杆菌复合体感染模型:恩美唑巴坦可使9种头孢吡肟耐药的产ESBL的肺炎克雷伯菌的细菌负荷降低一个对数单位的合适PD靶值为16%fT>2μg/ml,但由于不同菌株间变异度高,保守起见选取75分位PD靶值45%fT>2μg/ml;
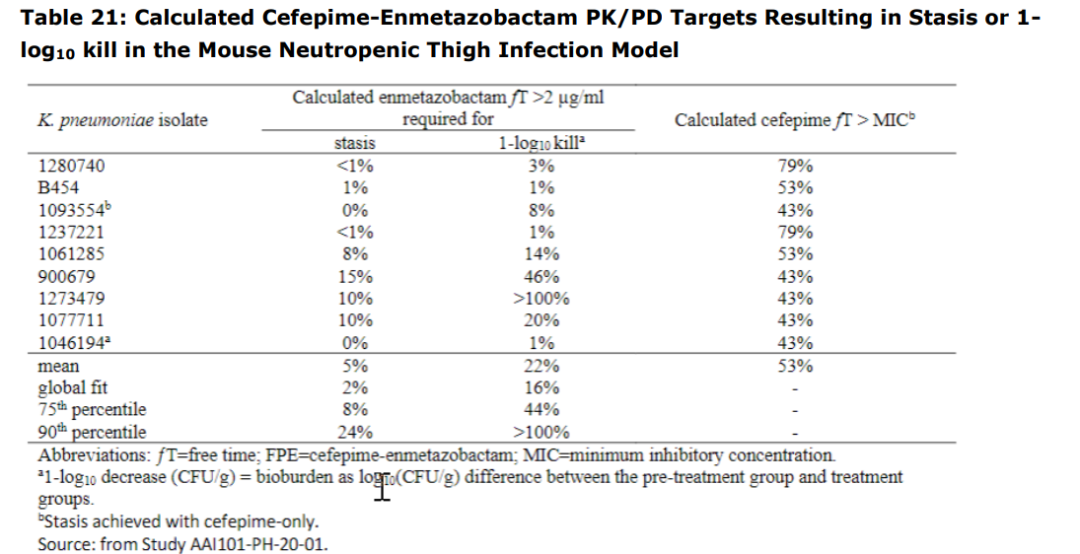
参考资料:Exblifep EMA Assessment Report
③使用来自1期健康人+2期cUTI患者+3期cUTI患者的PopPK模型进行蒙卡洛模拟,结果显示中性细胞减少的小鼠大腿感染模型中非临床PD靶值45%fT>2μg/ml的达标概率很高。
图片参考资料:Exblifep EMA Assessment Report
2-PopPK分析
①利用AT-103试验数据建立血浆和ELF的PopPK模型,参数如下:
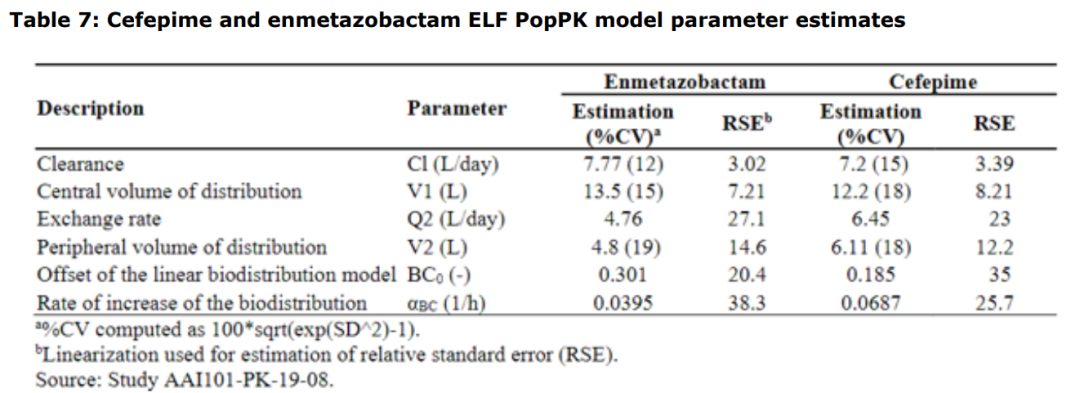
参考资料:Exblifep EMA Assessment Report
②确定头孢吡肟和恩美唑巴坦的ELF/血浆比值,结果显示头孢吡肟和恩美唑巴坦以相似的方式渗透健康人肺部,ELF/血浆分布系数均在45%以上。
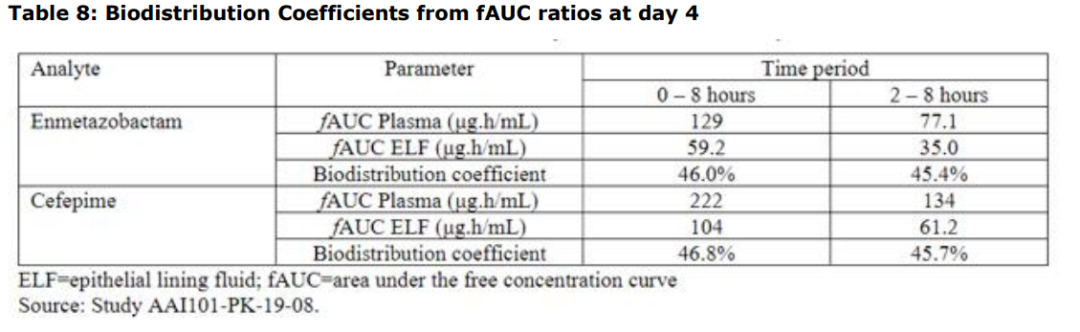
参考资料:Exblifep EMA Assessment Report
3-进行ELF达标概率分析
用3期cUTI患者数据更新的PopPK模型,健康人头孢吡肟和恩美唑巴坦的ELF/血浆生物分布,以及小鼠大腿感染模型的PD靶值进行模拟,结果显示2h静脉输注的暴露量不足以最大化药物对肺部感染的疗效,而4h静脉输注可使不同程度肾功能分组(除外肾清除增加、肾功能严重不足需要透析)的人群的达标概率>90%。因此,建议治疗HAP/VAP,静脉输注时间由2h延长至4h。
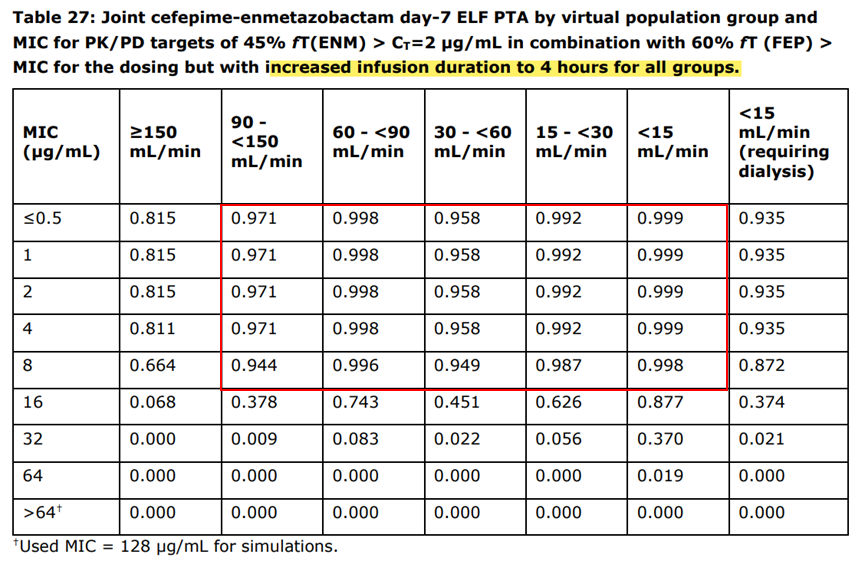
参考资料:Exblifep EMA Assessment Report
备注:红框内显示静脉输注由2h变为4h后,达标概率提升的分组。
总结
头孢吡肟/恩美唑巴坦通过3期临床证明了对cUTI患者的有效性;通过非临床PK-PD分析确立了恩美唑巴坦的PD靶值是45%fT>2μg/ml+PopPK建模进行PTA确定了复方中恩美唑巴坦剂量选择的合理性;通过健康人ELF和血浆药物浓度试验确定了头孢吡肟和恩美唑巴坦的ELF/血浆分布系数,利用非临床PD靶值+ELF PopPK更新模型再次进行PTA豁免了HAP/VAP的3期临床试验。
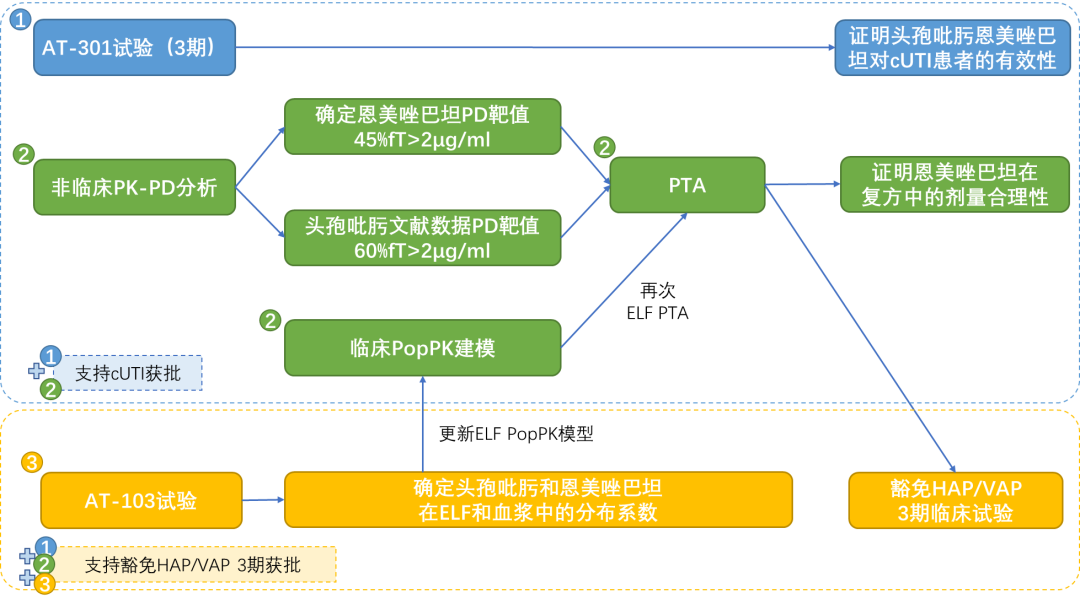
参考资料:Exblifep EMA Assessment Report
其实,上述基于“cUTI有效性数据+PK-PD分析+ELF药物分布”豁免HAP/VAP验证性临床的策略早有先例:EMA曾基于cUTI 3期数据+小型开放标签HAP/VAP试验获批了美罗培南/法硼巴坦治疗HAP/VAP;头孢他啶/阿维巴坦治疗HAP/VAP获批先于完成HAP/VAP 3期试验之前。不过,头孢吡肟/恩美唑巴坦完全豁免了在HAP/VAP患者中进行临床试验,可供借鉴。
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030