https://www.cphi.cn 2020-11-09 10:36 来源:CPhI制药在线 作者:向东
阿尔茨海默症(AD)是一种中枢神经系统退行性疾病,主要临床表现为记忆力衰退、认知功能受损、**行为改变以及日常生活能力减退,患者进入中晚期容易发生多种并发症,患者需要长期全面的照料,给家庭和社会带来沉重的经济负担。根据国际AD协会发布的《2019年世界阿尔茨海默症报告》中,2019年,全球有超过5000万人患有痴呆症,到2050年,将增加到1.52亿。
阿尔茨海默症治疗领域已长期无新药上市,据统计有 220 万美国人因阿尔茨海默症而患有轻度痴呆症,而目前我国的阿尔兹海默症患者约有1000万人,是世界上患者人数最多的国家。可以预见,如果在全世界范围内有一款阿尔茨海默症新药获批上市,其可能会成为有史以来最畅销的药物之一。
阿尔茨海默症(AD)药物开发道阻且长
目前在全球范围内,仅有6种阿尔茨海默症(AD)药物获美国FDA批准上市(他克林、多奈哌齐、卡巴拉汀、加兰他敏、盐酸美金刚、多奈哌齐+美金刚复方制剂)。然而,所有这些药物都只是对症治疗,没有一种能够阻止或者延缓AD病情的进展。
在中国,去年NMPA批准了阿尔兹海默症药物"九期一"甘露特钠胶囊上市,引起了极大的轰动。该药物为绿谷制药科研团队历时22年研究,是国际首个靶向脑-肠轴的阿尔茨海默病药,可用于治疗轻度至中度阿尔茨海默病。但是对于该药物的有效性,不论在国内还是国外均受到了部分学者的质疑。
其实,针对"九期一"的质疑除了其本身临床试验数据方面的原因外;更多的是阿尔兹海默症药物的研发十分困难,鉴于中国在新药研发领域的影响力,很多学者对于中国能在该领域取得突破性成果持怀疑态度。因为据统计在过去20多年间,全球各大药企在阿尔兹海默病新药研发中共投入6000亿美元,但各家药企的320个药物相继宣告失败。
包括但不限于以下制药巨头均在AD药物领域尝到了败果。2012年,辉瑞、强生和Elan制药联合开发的阿尔兹海默症药物在临床测试中的结果极差,宣布停止研发;2016年,礼来承认花费26年的新药研发失败;2017年,默沙东宣告新药试验终止;2018年,阿斯利康与礼来共同宣布,停止一种用于治疗早期和轻度阿尔茨海默症患者药物的全球试验。
阿尔兹海默症药物的开发之所以如此困难,主要是因为目前对于该病的认识并不是十分透彻。既往随着医学研究的不断深入,医学界提出了"淀粉样蛋白假说",该假说认为阿尔茨海默症的病理变化主要是因为大脑β淀粉样蛋白(β-amyloid,Aβ蛋白)沉积形成老年斑(Plaque),Tau蛋白过度磷酸化造成神经纤维缠结(NFTs)以及神经元丢失,并伴随胶质细胞增生,最后导致认知功能障碍。
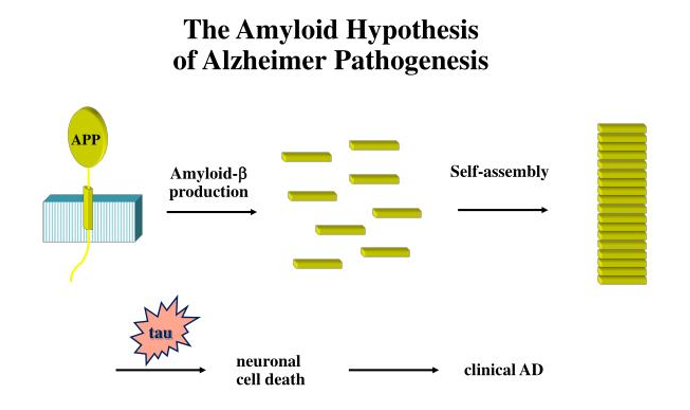
图1. 淀粉样蛋白假说[1]
β淀粉样蛋白是一种出现在AD患者脑内的神经**蛋白,曾长期被人们视为引发神经细胞凋亡和继发性认知障碍的罪魁祸首。然而,随着众多阻断Aβ的小分子药物和抗体在AD药物开发领域的失败,"淀粉样蛋白假说"的真实性越来越受到相关科学家的质疑。
但就在人们即将对"淀粉样蛋白假说"失去信心的时候,原本已被判失败的渤健(Biogen)与卫材(Eisai)开发的Aβ人单克隆抗体Aducanumab却出现了反转性结果,基于这一结果渤健与卫材提交了Aducanumab在美国的上市申请。
AD新药Aducanumab开发几经波折
Aducanumab是一种靶向β淀粉样蛋白的单克隆抗体,它能有选择性地与患者大脑中的淀粉样蛋白沉积结合。2019年3月,渤健发布了两项针对阿兹海默症轻度认知障碍患者的全球III期临床研究(ENGAGE研究和EMERGE研究)的初步中期分析数据,数据表明Aducanumab未能达到主要研究终点,在此结果的基础上渤健宣布并停止了该药的开发。
然而,在后续的数据分析中发现,高剂量Aducanumab治疗的亚组患者AD病情明显改善。在2019年10月下旬,渤健宣布在与美国FDA对试验数据进一步讨论并分析后,得出了反转性结果。其中,EMERGE研究到了主要终点,Aducanumab减少了AD患者的认知下降,数据具有显著的临床意义。
2019年12月,渤健发布了EMERGE研究和ENGAGE研究的详细分析数据。在EMERGE研究78周的观察时间中,接受高剂量Aducanumab治疗的患者达到了主要研究终点。与安慰剂组相比,接受高剂量Aducanumab治疗的患者临床痴呆评定量表CDR-SB(Clinical Dementia Rating-Sum of Boxes)评分降低了23%;此外,次要研究终点简易**状态检查表MMSE(Mini-Mental State Examination)评分降低15%;AD评定量表的认知分量表(ADAS-Cog 13)和日常生活能力量表(ADCS-ADL-MCI)评分则分别降低27%和40%。上述数据表明,相比安慰剂组,接受高剂量Aducanumab治疗的患者在认知和功能(如记忆力、方向和语言)方面有显著提升,日常生活活动也表现出受益。同时研究发现,此类患者脑脊液中Tau蛋白病理和神经退化性病变的生物标志物也有所减少。
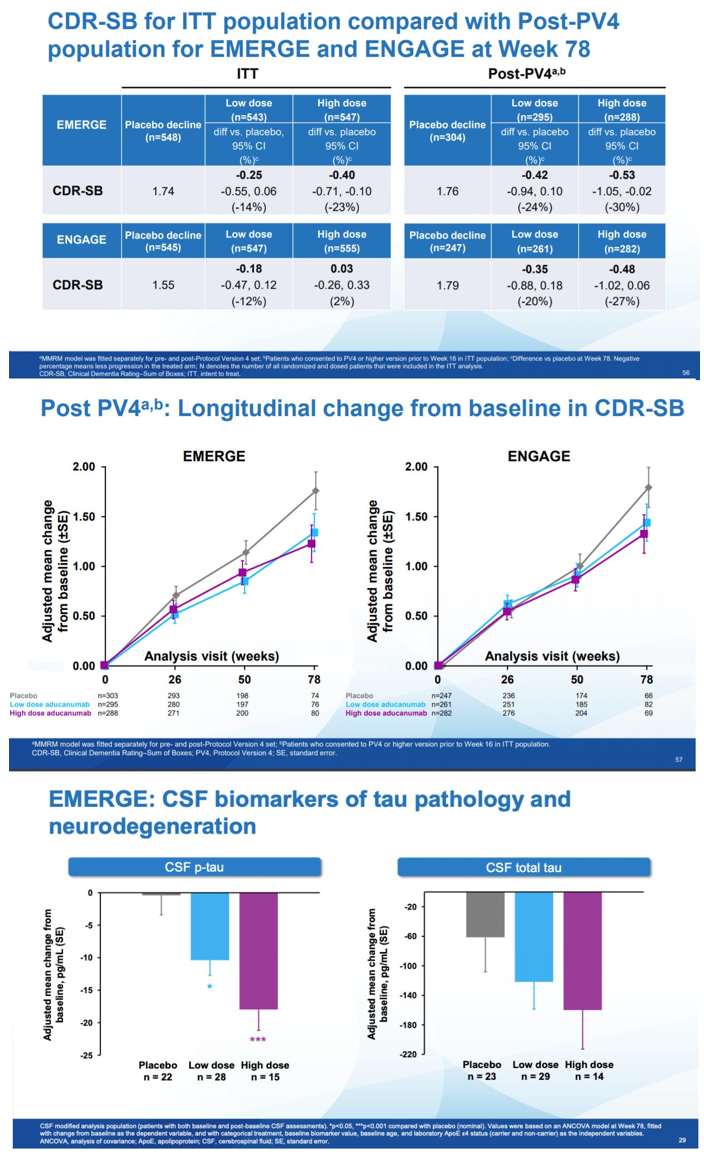
图2. EMERGE和ENGAGE研究结果 来源:渤健官网
然而,在渤健又对ENGAGE研究进行了重新分析后,其结果却没能像EMERGE研究一样表现出显著的临床意义。EMERGE与ENGAGE临床试验在理论上设计完全相同的,实验人数及受试者分布上无明显差异,但两个独立试验却得出了完全不同的结果。分析可能造成这种差异的原因,渤健认为这可能与给药剂量的变化有关。
在渤健前期的EMERGE与ENGAGE研究中,携带ApoE ε4等位基因的患者(ApoE ε4+)接受的Aducanumab最高剂量为6 mg/kg;而ApoE ε4-的患者可以接受的最高剂量为10 mg/kg。但在后期修改的方案(Protocol Version 4, Pv4)中,ApoE ε4+的患者也可以接受最高剂量为10 mg/kg的Aducanumab的治疗,这造成了ApoE ε4+的患者前后接受的Aducanumab剂量并不统一。另外,由于EMERGE和ENGAGE两项研究在招募速度上的差异,导致在两项研究的高剂量组中,接受10 mg/kg的Aducanumab治疗的患者比例有显著差别。其中,在EMERGE研究的高剂量组中,有76 %的患者接受了14次10 mg/kg的完整治疗;而在ENGAGE研究的高剂量组中有62 %的患者,这是这两组患者之间的一个重要不同之处,也许是导致数据差异的根本原因。
然后,渤健分析了在新版方案的流程下(Post-PV4),即入组的高剂量患者均能够接受10 mg/kg的Aducanumab治疗的亚组人群后,发现EMERGE与ENGAGE研究中高剂量组患者的CDR-SB评分分别较安慰剂组降低了30 %和27 %。这些数据表明,不论在EMERGE和ENGAGE组中,持续接受10 mg/kg剂量的Aducanumab治疗的患者能够获得AD疾病进程的减缓。基于上述研究结果发现,渤健认为10 mg/kg剂量的Aducanumab能够显著改善AD患者的认知能力。
今年7月初,渤健与卫材向美国FDA提交Aducanumab的BLA。11月4日,FDA在针对Aducanumab两项临床试验数据的内部审查中给出了积极意见;然而,11月6日在FDA针对Aducanumab召开的外部专家咨询委员会上,几乎所有外部专家都给Aducanumab给出了负 面 评价。虽然并没有法规要求FDA需要遵循专家组的意见决定一款药物上市与否,但是这些否定意见一定会对FDA是否批准Aducanumab上市产生重大影响。
结语
FDA对Aducanumab的上市做出何种决定目前尚不得而知,但是可以想象到,不论哪种决定,对阿尔茨海默症(AD)药物的开发均将产生重大的影响。
如果获得批准,Aducanumab 将成为近二十年来真正意义上第一个获得国际承认的新的阿尔茨海默症治疗药,并且是第一个通过靶向消除 β-淀粉样蛋白而缓解认知下降或阻止阿尔茨海默症进展的药物,有此先例后续企业也将更有勇气有动力去开发这一领域的药物;而如果Aducanumab的上市申请不被许可,这将是对所有正在涉足或者试图涉足这一领域药物的一次重大打击,毕竟这是目前在研AD药物离上市最近的一次,这一结果可能会导致药企在进入阿尔茨海默症药物领域时更加慎重,甚至放弃在这一领域的开发。
当然,江山代有才人出,药物开发领域也是如此。不论此次Aducanumab的上市之路如何,可以相信只要阿尔茨海默症不被人类攻克,就会一直有源源不断的新药在攻克阿尔茨海默症这条路上涌现,有效药物的出现只是时间长短的问题而已。
值得一提的是,就在近日 "九期一"甘露特钠胶囊已经正式在美国启动国际多中心Ⅲ期临床试验的患者入组工作。离开国内主场去国际舞台上验证相关药物的有效性,绿谷制药可谓信心与勇气二者皆足,在此期待其取得积极的结果。
参考来源:
[1] The Amyloid Hypothesis of Alzheimer Pathogenesis
[2] 渤健官网
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030