https://www.cphi.cn 2023-12-08 14:02 来源:CPHI制药在线 作者:忆
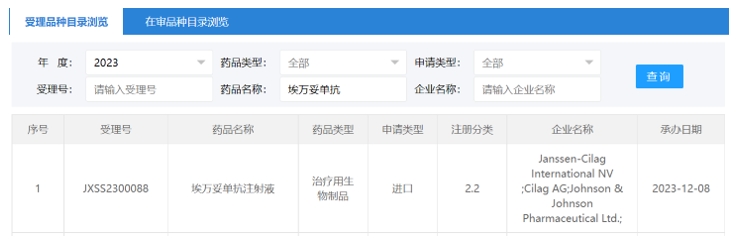
12月8日,强生「埃万妥单抗注射液」的2.2类注册申请获CDE受理。据公开资料,埃万妥单抗(Amivantamab)是一种针对表皮生长因子受体(EGFR) 和间质表皮转化因子(MET)受体的双特异性抗体,2021年5月被FDA批准用于治疗铂类化疗治疗中或之后疾病进展的携带EGFR外显子20插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者,商品名为Rybrevant。
今年7月,强生宣布Rybrevant联合化疗一线治疗新诊断EGFR外显子20插入突变晚期或转移性NSCLC的3期临床研究PAPILLON取得积极结果。该试验是一项全球随机、开放标签试验,共入组308例未接受过治疗的晚期EGFR外显子20插入突变 NSCLC患者,试验中患者按1:1比例随机分组,分别接受Rybrevant联合化疗(培美曲塞+卡铂)或单纯化疗治疗。
结果显示:中位随访14.9个月,Rybrevant+化疗组的中位PFS为11.4个月,显著超过化疗组的6.7个月。而且,Rybrevant+化疗组的缓解率为73%,高于化疗组的47%。18个月时,Rybrevant+化疗组的无进展生存率为31%,化疗组仅为3%。
安全性方面,治疗相关不良事件与Rybrevant和化疗的预期毒性相符。Rybrevant+化疗组的≥3级不良事件发生率为75%(Vs化疗组为54%)。Rybrevant+化疗组的最常见不良事件是中性粒细胞减少、甲沟炎和皮疹。
笔者推测此次Rybrevant在国内申报的适应症是联合化疗一线治疗新诊断EGFR外显子20插入突变的晚期或转移性NSCLC。
EGFR外显子20插入突变(Exon 20ins)是继晚期NSCLC患者EGFR两大常见突变(19号外显子缺失突变和21号外显子 L858R点突变)以外的第三大突变,占EGFR突变的10%和所有NSCLC 2%左右。EGFR Exon 20ins NSCLC恶性程度高,异质性强,患者预后差,化疗和传统的一至三代EGFR TKI靶向药物疗效不理想。
近年来,全球多款新药被开发用于EGFR Exon 20ins NSCLC的一线治疗,如舒沃替尼、Mobocertinib(莫博赛替)、YK029A、伏美替尼。
舒沃替尼是迪哲医药研发的一款口服、不可逆、针对多种EGFR突变亚型的高选择性EGFR TKI,今年8月在国内被批准用于既往经含铂化疗出现疾病进展,或不耐受含铂化疗,并且经检测确认存在EGFR外显子20插入突变的局部晚期或转移性NSCLC患者。
2023 ESMO上公布的舒沃替尼一线治疗EGFR Exon 20ins NSCLC的两项临床试验"悟空1"(WU-KONG1)和"悟空15"(WU-KONG15,NCT05559645)数据显示:截至2023年2月21日,共28例初治EGFR Exon 20ins NSCLC纳入疗效分析集。舒沃替尼单药一线治疗EGFR Exon 20ins NSCLC患者,在RP2D剂量(300mg QD)下的最 佳ORR达77.8%。至数据截止日期,最长治疗持续时间超过9.8个月,超过80%的肿瘤缓解患者仍处于持续缓解中,中位 DoR仍未达到。安全性和既往报道一致,最常见的≥3级TEAEs包括腹泻、CPK升高和皮疹,大多数不良反应为CTCAE 1-2级,临床可管理可恢复,没有患者出现药物相关停药TEAEs。
Mobocertinib(莫博赛替尼,Exkivity)是武田开发的一种新型、高选择性EGFR靶向TKI,2021年9月被FDA批准用于治疗在含铂化疗治疗期间或治疗后进展的局部晚期或转移性、携带EGFR Exon 20ins的NSCLC成年患者。遗憾的是,今年7月武田在公布第一季度财报时宣布Mobocertinib一线治疗EGFR Exon 20ins NSCLC的3期临床试验EXCLAIM-2因无效而终止。
YK-029A是苏州浦合医药开发的一种口服、不可逆第三代EGFR TKI,2022年9月被CDE纳入突破性治疗品种,用于未经系统治疗的EGFR Exon 20ins晚期NSCLC患者。
2023 ASCO上公布的YK-029A的首 个临床研究成果显示:在携带EGFR Exon 20ins突变的初治队列中,26例患者被纳入疗效分析集。截至2022年10月30日,19例患者实现部分缓解,5例患者病情稳定,2例患者出现疾病进展。经证实的独立影像评估委员会评估的ORR高达73.1%,DCR为92.3%,mPFS为9.3个月,9个月的PFS率为63.7%,1年OS率为83.1%。而且,在所有可评估的亚组(包括脑转移患者及不同EGFR Exon 20ins突变亚型的患者)中,均能观察到治疗应答。
安全性方面,剂量递增阶段未发生剂量限制性毒性反应(DLT),未达到最大耐受剂量(MTD)。试验中最常见的TEAEs是腹泻(46.3%)、贫血(38.0%)和皮疹(32.4%)。
伏美替尼是艾力斯医药研发的一款口服、小分子、高透脑、泛EGFR突变TKI,靶向经典(外显子19缺失和L858R)和非典型EGFR突变,包括外显子20插入突变。2021年3月,该药在国内被NMPA批准用于二线治疗携带EGFR 20号外显子T790M耐药突变的局部晚期或转移性NSCLC成人患者,2022年6月被NMPA批准一线治疗携带EGFR 19Del或21L858R 的局部晚期或转移性NSCLC成人患者。
今年10月,伏美替尼被FDA授予突破性疗法认定,用于先前未接受过治疗、局部晚期或转移性非鳞状NSCLC且伴有EGFR 20号外显子插入突变患者。已公布的伏美替尼在EGFR Exon 20ins晚期NSCLC中开展的1b期临床研究FAVOUR结果显示:无论是初治还是经治的患者,伏美替尼均显示出良好的抗肿瘤活性和耐受性。在初治患者中,确认的ORR为78.6%,中位缓解持续时间(mDoR)为15.2个月;在既往治疗的患者中,240mg和160mg剂量均有效,ORR分别为46.2%和38.5%。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030