https://www.cphi.cn 2024-02-20 09:48 来源:药渡 作者:五月
2月1日,默沙东发布了2023年业绩报告,2023年其全球销售额为601亿美元,较2022年全年增长1%,不包括LAGEVRIO,增长率为9%,除去LAGEVRIO和外汇影响,增长12%。
第4季度全球销售额为146亿美元,较2022年第4季度增长6%,不包括LAGEVRIO,增长率为11%,除去LAGEVRIO和外汇影响,增长13%。

图1. 默沙东2023年及4季度业绩情况,来源:其财报
PART.01
K药大卖250亿美元
首次登顶药王宝座
K药(Keytruda)是由默沙东研发于2014年9月首次获美国FDA批准的PD-1免疫药物,用于晚期恶性黑色素瘤患者。自首次获批之后,K药的获批范围不断扩大,在2017年5月,K药获FDA加速批准用于微卫星高度不稳定(MSI-H)或者错配基因修复缺陷(dMMR)类型的多种实体瘤,成为FDA批准的首 款不按照肿瘤的来源,而是按照生物标志物就可以使用的抗癌药[1]。
随着适应症不断扩大,K药销售额急剧上升,在获批后的第5年(2019年)销售额超100亿美元,第8年(2022年)突破200亿美元,达到209.37亿美元,以3亿美元之差惜败修美乐无缘药王宝座。
2023年,K药终于打败昔日药王修美乐登顶药王宝座,2023年全球销售额增长19%至250亿美元,剔除汇率影响,销售额增长22%,其中第4季度销售额达到66亿美元,同比增长22%(图2)[2,3]。
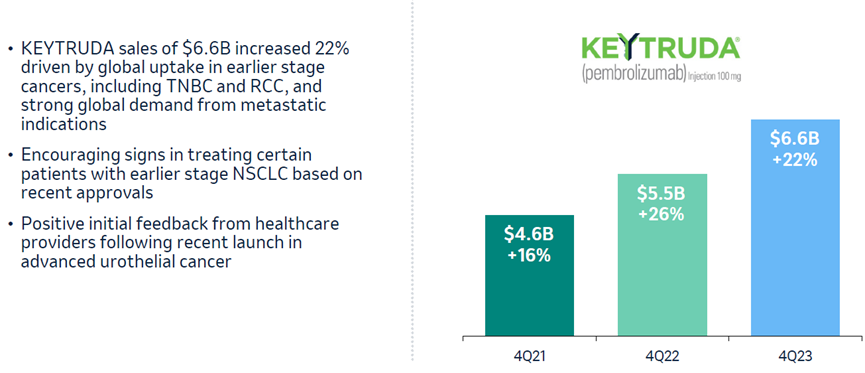
图2. K药2021-2023年第4季度销售额
早期,默沙东报道了K药KEYNOTE-671、KEYNOTE-564、KEYNOTE-123和KEYNOTE-942等临床试验积极结果(图3),近期,默沙东更新了部分试验结果。

图3. K药关键试验
此前,基于III期KEYNOTE-564的无病生存期(DFS)数据,K药在美国、欧盟、日本和全球其他国家被批准用于肾细胞癌(RCC)患者的辅助治疗。
2024年1月27日,默沙东公布用于评估治疗RCC患者辅助治疗效果KEYNOTE-564试验的第三次预先指定的中期分析(中位随访57.2个月[范围,47.9-74.5个月])结果:与安慰剂相比,K药作为辅助治疗显著提高了38%的总生存期(OS),这是该试验的关键次要终点。
在48个月时,接受K药治疗的患者OS率为91.2%,而接受安慰剂治疗的患者为86.0%,在关键亚组中观察到接受K药治疗患者的OS获益[4]。
在中位随访24.1个月的早期预先指定的中期分析中,KEYNOTE-564达到了无病生存期(DFS)的主要终点,与安慰剂相比,疾病复发或死亡风险降低了32%。
2024年1月26日,默沙东宣布K药辅助治疗局限性肌层浸润性尿路上皮癌(MIUC)和局部晚期可切除尿路上皮癌高危患者的III期KEYNOTE-123试验的结果:在试验的首次预先指定的中期分析中,在中位随访22.3个月后,K药在主要终点之一DFS上显示出统计学上显著和临床意义的改善,与术后观察相比,疾病复发或死亡的风险降低了31%。
K药的中位DFS为29.0个月,对照组为14.0个月,改善了15个月。无论患者的PD-L1表达状态如何,这些DFS结果都是一致的。该试验的另一个主要终点OS在本次中期分析时未达到统计学意义,随着数据的成熟,将继续进行随访。中位随访36.9个月后,K药组的中位OS为50.9个月,而对照组为55.8个月[5]。
除此之外,默沙东还公布了K药一些新的进展:
1.2024年1月12日,默沙东宣布FDA已批准K药与放化疗(CRT)联合用于治疗FIGO(国际妇产科学联合会)2014年所定义的III-IVA期宫颈癌患者。
该批准基于KEYNOTE-A18 III期试验的数据,在该试验中,与安慰剂加CRT相比,K药联合CRT在FIGO 2014 III-IVA期患者中的无进展生存期(PFS)有所改善,疾病进展或死亡风险降低了41%;两组均未达到中位PFS。此次获批标志着K药开启了治疗宫颈癌的第三个适应症,也是K药在美国的第39个适应症[6]。
2.2023年12月18日,欧盟委员会批准K药联合化疗用于一线治疗表达PD-L1(CPS ≥1)和晚期胆道癌的晚期HER2阴性胃癌或胃或胃食管交界处(GEJ)腺癌患者。自此,K药在欧盟获批了26个适应症,包括7个胃肠道癌症。
此次批准遵循了人用药品委员会在2023年10月和2023年11月收到的积极建议,并分别基于III期KEYNOTE-859和KEYNOTE-966试验的总生存期(OS)结果[7]。
在KEYNOTE-859中,K药联合化疗显著改善了整体患者群体的OS,与单独化疗相比,死亡风险降低了22%。在肿瘤表达PD-L1(CPS ≥1)的患者中,K药联合化疗可使死亡风险降低26%。接受K药联合化疗的患者的中位OS为13.0个月,而单独化疗组的中位OS为11.4个月。
在KEYNOTE-966中,K药联合化疗显示出OS的统计学显著改善,与单独化疗相比,死亡风险降低了17%。K药联合化疗组的中位OS为12.7个月,而化疗组的中位OS为10.9个月。
3.2023年12月15日,FDA批准K药联合Padcev扩大适应症,用于局部晚期或转移性尿路上皮癌成人患者的一线治疗。相关文章传送门:重磅ADC/Keytruda组合疗法获FDA批准,OS和PFS翻倍!ADC联合PD-1/L1时代来临
此次批准是基于III期KEYNOTE-A39试验结果:与铂类化疗相比,K药联合Padcev在试验的主要疗效终点OS和PFS方面,显示出统计学上的显著改善。
与铂类化疗相比,K药联合Padcev可将死亡风险降低53%。K药联合Padcev组的中位OS为31.5个月,而铂类化疗组的中位OS为16.1个月。K药联合Padcev组的中位PFS为12.5个月,而铂类化疗组为6.3个月[8]。
PART.02
超220亿美元围猎ADC
除了K药,默沙东也在积极寻找新的增长点,对此,默沙东把目光瞄准当下大火的ADC领域,2022年默沙东先后与科伦药业达成超百亿美元的三项协议,2023年更是斥资总金额高达220亿美元与第一三共达成合作协议,共同开发Patritumab Deruxtecan(HER3-DXd)、I-DXd(DS-7300)和R-DXd三款产品。
Patritumab deruxtecan
Patritumab deruxtecan是由第一三共原研的一款靶向HER3的ADC药物,由HER3单抗patritumab与拓扑异构酶I抑制剂deruxtecan通过可裂解的四肽连接链连接而得(图4)。
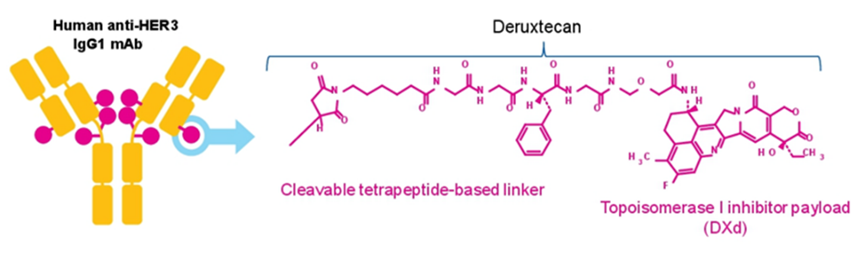
图4. Patritumab deruxtecan的结构
Patritumab Deruxtecan是目前进展最快的HER3 ADC药物,它的生物制品许可申请(BLA)于2023年12月份获美FDA受理并授予优先审评,适用于既往至少接受过两种系统治疗的EGFR突变型局部晚期或转移性NSCLC患者,成为首 款申报上市的HER3 ADC药物,处方药用户费用法案(PDUFA)日期为2024年6月26日[9,10]。
此次BLA基于HERTHENA-Lung01关键性II期试验的主要结果:在HERTHENA-Lung01中,patritumab deruxtecan在225例接受了EGFR TKI和铂类化疗疾病进展后EGFR突变的局部晚期或转移性NSCLC患者中进行了研究,结果显示客观缓解率(ORR)为29.8%(95%CI:23.9-36.2),包括1例完全缓解和66例部分缓解。中位缓解持续时间为6.4个月(95%CI:4.9-7.8)(图5)。

图5. Patritumab Deruxtecan试验方案
I-DXd
I-DXd是由第一三共研发的一种新型B7-H3 ADC药物,通过可裂解的四肽连接链将B7-H3抗体与拓扑异构酶I抑制剂Dxd偶联而得(图6)[1]。
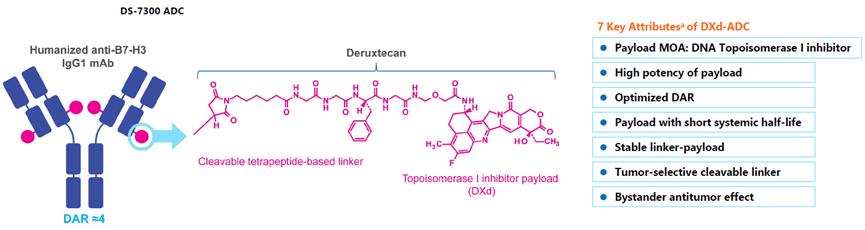
图6. DS-7300a的结构
此前的临床试验显示了I-DXd在小细胞肺癌(SCLC)中有良好的疗效,cORR为52.4%,mPFS为5.6个月[12]。基于此,默沙东/第一三共计划开展一项用于治疗既往接受过至少一种铂类药物的复发性SCLC患者的III期IDeate-Lung02研究(图7)。
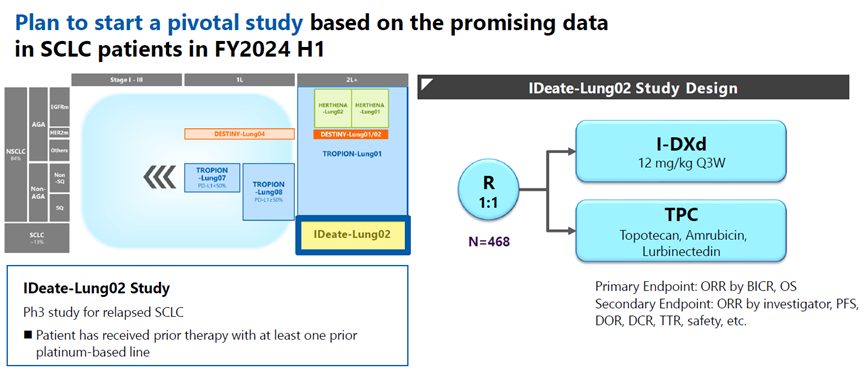
图7. IDeate-Lung02试验方案
R-DXd
R-DXd是由第一三共原研的靶向CDH6的同类首 创ADC产品。
2023年的ESMO会议上,R-DXd的首次人体I期研究亚组分析结果显示:在既往接受过多种治疗且铂类耐药的晚期卵巢癌患者中,R-DXd治疗组的ORR为38%(13/34),两名未证实部分缓解的患者仍在接受治疗[13]。
基于此,默沙东/第一三共计划开展R-DXd的用于治疗铂耐药的卵巢癌患者的临床II/III期REJOICE-Ovarian01试验(图8)。
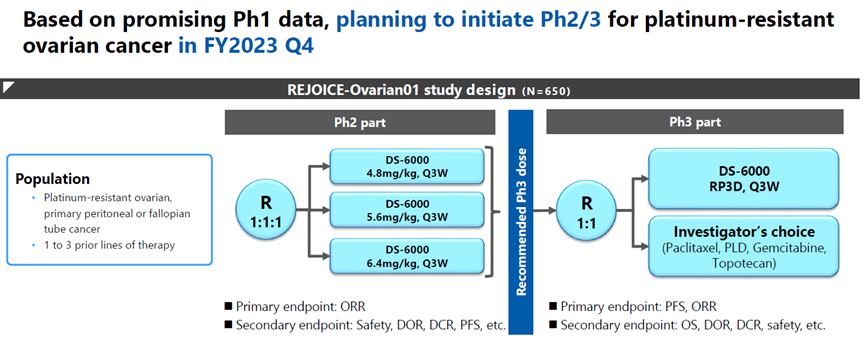
图8. REJOICE-Ovarian01试验方案
PART.03
HPV疫苗节节攀升
授权“千亿大单”
GARDASIL是由默沙东研发的一种针对HPV-6、HPV-11、HPV-16和HPV-18四种类型的HPV(人类乳头瘤病毒)疫苗,GARDASIL 9是默沙东研发的第三代防御HPV相关疾病的疫苗产品,它可以帮助预防9种HPV,包括类型6,11,16,18,31,33,45,52和58。
2023年第四季度,GARDASIL/GARDASIL 9的销售额增长27%至19亿美元,2023年全球销售额增长29%至89亿美元,剔除汇率影响,销售额增长33%(图9)。
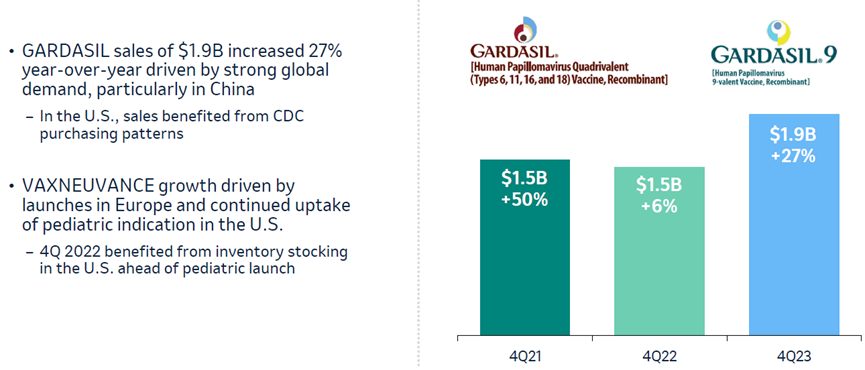
图9. GARDASIL/GARDASIL 9 2021-2023第4季度销售额
GARDASIL/GARDASIL 9疫苗的强劲增长主要得益于市场需求的增加,尤其是中国市场。
2023年1月份,智飞生物与默沙东续签了独家代理协议,根据协议,智飞生物与默沙东本次协议约定的HPV疫苗综合基础采购计划额为:2023年下半年214.06亿元、2024年326.26亿元、2025年260.33亿元、2026年178.92亿元,加上之前签订的2023年上半年采购金额62.6亿元的协议,2023-2026年总金额超千亿元。
目前国内上市的HPV疫苗中,只有智飞生物代理的属于九价HPV疫苗,该九价HPV疫苗于2022年被中国国家药品监督管理局(NMPA)扩展适用人群至9-45岁适龄女性范围,并且于2024年1月获得NMPA批准9-14岁女性二剂次接种程序(0,6~12月)[14]。
该二剂次接种程序减少一次接种次数,减轻了经济负担,还会释放更多疫苗资源,有利于小年龄段女性接种率提升,进一步拓展了小年龄组市场,市场占有率有望进一步提升。
小结
K药依然是默沙东最大的收入来源,随着新适应症的扩增,2024年全球销售额有望进一步提高,除此之外,默沙东在肿瘤领域还有Lynparza、Lenvima和WELIREG等重磅产品。
疫苗板块GARDASIL/ GARDASIL 9贡献了89亿美元的收入,第四季度肺炎球菌结合疫苗V116获得FDA优先审评。
默沙东预计2024年全年全球销售额将在627亿美元至642亿美元之间,预计非GAAP(净利润)每股收益将在8.44美元至8.59美元之间。
参考文献:
1.药时代:乘风破浪的K药:意外诞生的新时代抗癌药代表
2.Merck Announces Fourth-Quarter and Full-Year 2023 Financial Results
3.Merck Q4 2023 Earnings February 1, 2024
4.Merck’s KEYTRUDA? (pembrolizumab) Reduced the Risk of Death by 38% Versus Placebo as Adjuvant Therapy for Patients With Renal Cell Carcinoma (RCC) at an Increased Risk of Recurrence Following Nephrectomy
5.Merck’s KEYTRUDA? (pembrolizumab) Significantly Improved Disease-Free Survival (DFS) as Adjuvant Therapy Versus Observation in High-Risk Patients With Localized Muscle-Invasive and Locally Advanced Urothelial Carcinoma After Surgery
6.FDA Approves Merck’s KEYTRUDA? (pembrolizumab) Plus Chemoradiotherapy as Treatment for Patients With FIGO 2014 Stage III-IVA Cervical Cancer
7.European Commission Approves Merck’s KEYTRUDA? (pembrolizumab) Plus Chemotherapy for New First-Line Indications in Advanced HER2-Negative Gastric or GEJ Adenocarcinoma in Tumors Expressing PD-L1 (CPS ≥1) and Advanced Biliary Tract Cancer
8.FDA Approves Expanded Indication for KEYTRUDA? (pembrolizumab) Plus Padcev? (enfortumab vedotin-ejfv) for the First-Line Treatment of Adult Patients With Locally Advanced or Metastatic Urothelial Cancer
9.Patritumab Deruxtecan Granted Priority Review in the U.S. for Certain Patients with Previously Treated Locally Advanced or Metastatic EGFR-Mutated Non-Small Cell Lung Cancer
10.DAIICHI SANKYO CO., LTD. FY2023 Q3 Financial Results Presentation
11.https://www.daiichisankyo.co.jp/files/investors/library/materials/2021/DS-7300%E5%8B%89%E5%BC%B7%E4%BC%9A.pdf
12.https://www.daiichisankyo.com/files/investors/library/quarterly_result/2023/FY2023_Q2_Financial_Results_Presentation_E_v2.pdf
13.745MO - Raludotatug deruxtecan (R-DXd; DS-6000) monotherapy in patients with previously treated ovarian cancer (OVC): Subgroup analysis of a first-in-human phase I study
14.华夏时报:默沙东九价HPV疫苗“变相降价”背后:2025年后将有多款国产九价HPV疫苗上市,竞争将会加剧
专栏作者
五月
药物化学硕博,国外博士后,现从事药物研发工作,热爱医药行业,愿与各位同行互相学习、进步,共同见证创新药的发展。
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030