https://www.cphi.cn 2019-07-04 10:20 来源:CPhI制药在线 作者:知行

2019年7月3日,Karyopharm Therapeutics宣布FDA批准其重磅新药XPOVIO™(Selinexor),与低剂量Dexamethasone联用治疗复发/难治多发性骨髓瘤,其针对的是已经过至少4种其他疗法并产生抗性的患者,Karyopharm预计于7月10日前实现Selinexor的上市销售。
多发性骨髓瘤(Multiple Myeloma,MM)是一种由于骨髓中浆细胞癌变造成的血液肿瘤,在血液肿瘤中排名第二,患者通常会出现骨痛、恶心、食欲下降、经常感染和贫血等症状。虽然目前有化疗、糖皮质激素和靶向药物等多种疗法改善MM患者生存,但由于其高度异质性,极易出现复发和耐药等特性,复发/难治MM(RRMM)的患者比例并不低且治疗棘手。
Selinexor是由Karyopharm研发的一种首创、口服、选择性核输出抑制剂(SINE),其通过结合并抑制核输出蛋白XPO1发挥作用,最终导致癌细胞选择性凋亡,同时又不会对正常细胞造成显著影响,已获得FDA授予的孤儿药和快速通道资格。
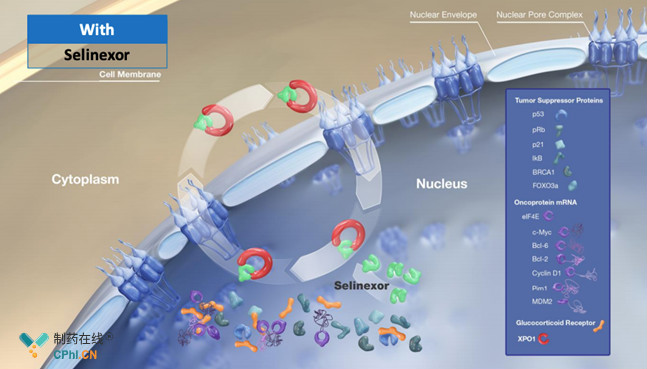
Selinexor作用机制(来源于Karyopharm官网)
在Ib/II期临床试验STOMP的Part 2部分,Karyopharm评估了Selinexor + Dexamethasone(80 mg + 20 mg,每周两次,第1天和第3天)治疗难治性MM患者的疗效和安全性,123名入组患者先前接受过多次治疗(bortezomib、carfilzomib、lenalidomide、pomalidomide、daratumumab,alkylator和glucocorticoids),并且对5种不同疗法产生耐药。
疗效数据显示,Selinexor联合低剂量Dexamethasone治疗高抗性MM时,取得26.2%的总缓解率(ORR)主要终点,其中两名患者完全缓解(sCR),30名患者达到部分缓解或良好部分缓解(PR+VGPR)。临床试验中,患者的平均缓解时间为4.4月,并且安全性数据与以往试验结果相符。
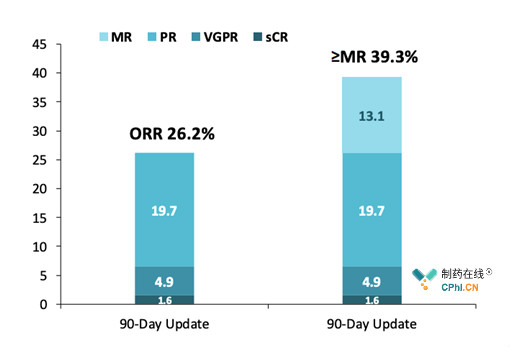
STOMP Part 2部分疗效数据(来源于Karyopharm官网)
2018年年未,基于STOMP的临床数据,Karyopharm向FDA递交了Selinexor的上市申请,用于治疗先前经过至少3种疗法的复发/难治型多发性骨髓瘤(RRMM),原定的PDUFA日期为2019年4月6日。
然而,今年3月份ODAC小组8:5认为应推迟Selinexor上市,应在获得其III期试验BOSTON数据(预计在2019年年未或2020年拿到)后评估是否上市,这项确认疗效试验评估了Selinexor + Velcade®(bortezomib) + Dexamethasone治疗多发性骨髓瘤的疗效和安全性。
2019年3月14日,FDA发表了一份针对Selinexor的声明,表示需要更多的数据以支持Selinexor上市,并将下一个PDUFA时间定在7月6日。
推迟决定并不是一个坏消息,相反是个好消息。Karyopharm认为FDA要求更多的数据,表明其对Selinexor有兴趣,希望更好的了解Selinexor的收益风险比,而Selinexor获批的机会也有增加。
2019年7月3日,FDA加速批准Selinexor上市,与Dexamethasone联用治疗复发/难治多发性骨髓瘤,适用于已接受过至少4种其他疗法的患者,并且对多种疗法产生抗性(两种蛋白酶体抑制剂,至少两种免疫调节剂和一种抗CD38单抗疗法),终成正果。
此次加速批准基于STOMP试验 Part 2部分中包含83名患者的数据结果,这些患者的总缓解率为25.3%,其中1名患者完全缓解,4名患者良好部分缓解,16名患者部分缓解,治疗4周时的患者首次出现缓解,平均缓解时间为3.8个月。
历经一波三折的审评后,Selinexor终于成功上市,为没有其他治疗选择的多发性骨髓瘤患者提供了新疗法。据EvaluatePharma估计,2024年Selinexor的销售额为12亿美元,成就重磅炸 弹。
Selinexor目前仅针对前期治疗失败的患者,可以说只是患者的最后选择,如果想要成为一线疗法还要多在安全性上下功夫。因为在STOMP试验中,27%的患者由于不良反应中止治疗,53%的患者治疗过程中降低了Selinexor剂量。
参考来源:
1. Go or no go? Karyopharm awaits a verdict on selinexor;
2. Karyopharm Announces FDA Approval of XPOVIO™ (selinexor) for the Treatment of Patients with Relapsed or Refractory Multiple Myeloma
作者简介:知行,用简单的语言讲述不简单的未来,一个不断前行的医药人。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030