https://www.cphi.cn 2023-02-16 23:43 来源:CPHI制药在线 作者:zhulikou431
2023年度可能获批的重磅仿制药,我们先看一下首仿药的情况。正如《闲聊2023年度可能获批的重磅仿制药(一)》中我们介绍过,在国内医药市场,首仿药的概念目前比较认可的说法主要是指"国内药品企业首先仿制并上市销售的仿制药品",它可以是原研药品在国内未上市的仿制药(化药3类),也可以是原研药品已在国内上市(包括进口)的仿制药(化药4类)。
本部分主要介绍的是以仿制药4类申报上市的首仿药。
01-马昔腾坦片
马昔腾坦(Macitentan,商品名:Opsumit/傲朴舒)是一种内皮素受体拮抗剂(ERA),用于肺动脉高压(PAH)的治疗,延缓疾病进展。
马昔腾坦原研公司是爱可泰隆(Actelion),该产品于2013年10月获FDA批准上市,是首 个获批用于PAH的口服制剂。2019年2月22日,财政部、海关总署、税务总局、国家药监局联合发布《关于罕见病药品增值税政策的通知》,马昔腾坦片位列首批罕见病药品清单。2017年10月爱可泰隆的马昔腾坦片获得国家药监局批准上市。
马昔腾坦片市场潜力巨大,2021年全球销售额超过18亿美元;在中国公立医疗机构终端销售额同比增长193.19%,2022年上半年突破1亿元大关。
目前江苏宣泰药业、南京正大天晴制药、杭州中美华东制药、南京泽恒医药、齐鲁制药、上海旭东海普药业均以仿制4类报产在审。宣泰药业和正大天晴是报产最早的两家企业,2019年就已经申报上市,而且2020年4月13日,由宣泰药业和普济生物联合开发,并由上海宣泰海门药业生产的马昔腾坦片(MacitentanTablets, 10 mg)获得美国食品药品监督管理局(简称“FDA”)暂定批准。另外上海上药睿尔药品也正在进行BE试验。(详见图1)

图1 马昔腾坦片注册进展(源自丁香园Insight数据库)
02-哌柏西利片
哌柏西利是全球首 个上市的细胞周期蛋白依赖性激酶(CDK)4/6抑制剂,可通过抑制CDK4/6恢复细胞周期控制,从而阻断肿瘤细胞增殖。
哌柏西利Palbociclib(商品名:Ibrance)是辉瑞的原研药,2015年2月Ibrance在美国获批上市,成为乳腺癌治疗的一类重要靶向药物。Ibrance上市后销售业绩基本上呈稳定增长趋势,2020年辉瑞Ibrance销售额突破50亿美元大关,2021年增速较为平缓,达54.4亿美元。在刚刚公布的辉瑞2022年财报中,Ibrance业绩有所下滑,但也达到了51.2亿美元 。
2018年7月,辉瑞哌柏西利胶囊获国家药监局批准上市,用于治疗激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的局部晚期或转移性乳腺癌。2020年12月齐鲁制药哌柏西利胶囊首仿获批上市,包括75mg、100mg、125mg三种规格。后续该产品又有江苏豪森药业、江西山香药业、四川科伦研究院、江苏奥赛康药业拿下生产批文。
2022年8月辉瑞的哌柏西利片在国内获批上市。目前齐鲁制药和石药欧意药业两家递交了哌柏西利片的上市申请,国内首仿药大概率将从两者之中决出。另外南京正大天晴也正在开始进行哌柏西利片的BE试验。(详见图2)
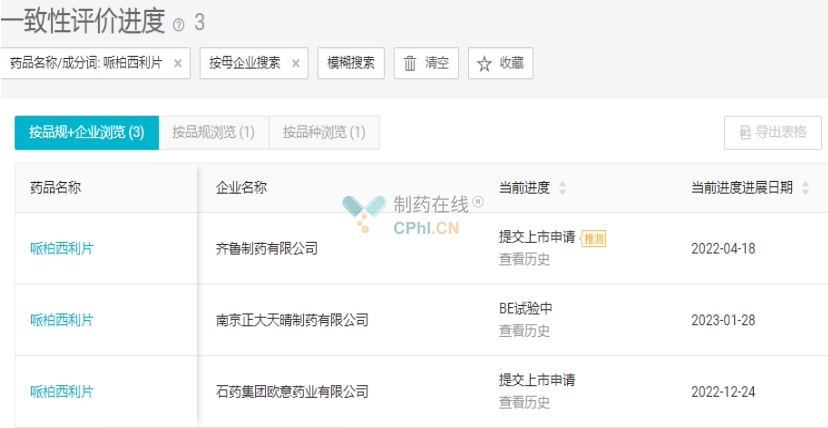
图2 哌柏西利片注册进展(源自丁香园Insight数据库)
03-艾曲泊帕乙醇胺片
艾曲泊帕乙醇胺片是首 个治疗ITP(原发免疫性血小板减少症)的口服药物,给药更加方便,患者依从性高,可明显降低出血率。
艾曲泊帕乙醇胺片(商品名:PROMACTA)原研是诺华,2008年11月20日NOVARTIS公司的PROMACTA®在美国获批,2010年3月Novartis Europharm Limited公司的Revolade®在欧盟获批上市,2017年Novartis Pharma Schweiz AG公司的Revolade®获国家药监局批准进口国内。
艾曲泊帕乙醇胺片市场潜力巨大,公开数据显示,2021年艾曲泊帕乙醇胺片在全球市场营销总额为20.16亿美元,2019年艾曲泊帕在国内销售额6900 多万元,2020年艾曲泊帕乙醇胺片在国内城市公立医院市场用药金额在1.8亿元左右,2021年在国内医院端销售额为3.6亿元,销量增长迅猛。
江苏奥赛康于2020年1月23日提交艾曲泊帕乙醇胺片的上市申请,是首家完成生物等效性试验并申报生产的企业。该产品首仿之争异常激烈,目前除了江苏奥赛康,还有正大天晴药业集团、齐鲁制药、四川科伦、印度熙德隆制药、重庆赛维药业、广东隆赋药业等多家药企报产待批。(详见图3)

图3 艾曲泊帕乙醇胺片注册进展(源自丁香园Insight数据库)
04-依维莫司片
依维莫司是哺乳动物雷帕霉素的衍生物,西罗莫司的衍生物,能够抑制肿瘤细胞生长与增殖、抑制肿瘤营养代谢和抗血管生成,起到三重抗肿瘤功效。
依维莫司片原研公司是瑞士诺华,2003年首次在瑞典获批上市,2006年已全面占领欧洲市场,2009年3月依维莫司片(商品名:Afinitor)在美国获批上市,是FDA十几年来首 个批准的肝移植免疫抑制剂,2013年6月依维莫司片获国家药监局批准进入中国市场。
近几年依维莫司片在全球销量稳步增长,据公开数据显示,该产品2016年全球销售19.14亿美元,2017年全球销售额19.39亿美元,2018年全球销售额20.20亿美元,2019年全球销售额20.24亿美元。
依维莫司片国内申报厂家较少,目前有正大天晴和迪康倍(苏州)生物医药两家企业以新4类仿制药报产,另外还有浙江海正和杭州华东医药正在进行BE试验。值得一提的是,正大天晴最早曾在2018年11月提交依维莫司片的上市申报,在2021年9月遭NMPA拒批,但随后在2022年1月正大天晴重新递交了上市申请,按照目前的进度仍有望以首仿身份获批。 (详见图4)
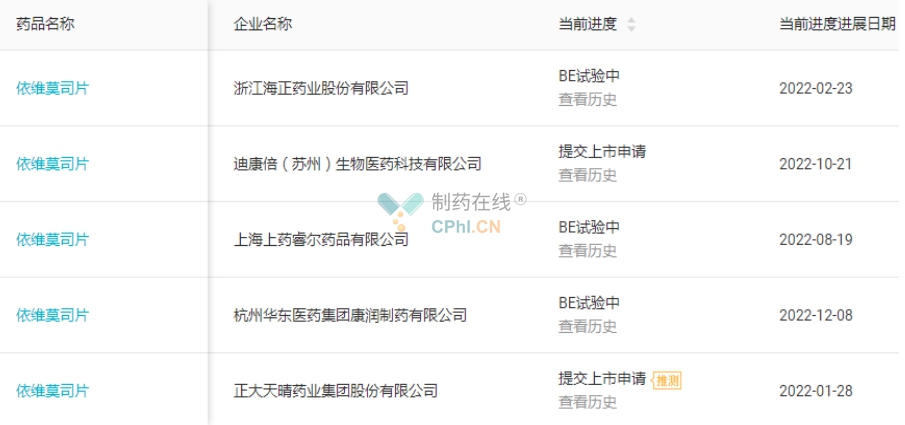
图4 依维莫司片注册进展(源自丁香园Insight数据库)
05-沙库巴曲缬沙坦钠片
沙库巴曲缬沙坦是由脑啡肽酶抑制剂沙库巴曲和血管紧张素受体拮抗剂缬沙坦组成的复方制剂,是近二十年来全球慢性心衰治疗领域的突破性创新药物,为全球首 个血管紧张素受体脑啡肽酶抑制剂(ARNI),可同时抑制脑啡肽酶和阻断AT1受体(血管紧张素II1型受体),临床上用于射血分数降低的慢性心力衰竭(NYHAⅡ-Ⅳ级,LVEF≤40%)成人患者,降低心血管死亡和心力衰竭住院的风险。
沙库巴曲缬沙坦钠片原研是诺华,2015年7月7日沙库巴曲缬沙坦钠片(商品名:Entresto)在美国获FDA批准上市,2017年获国家药监局批准进入国内市场,2019年起进入国家医保乙类谈判目录,2021年还新增了原发性高血压适应症。
诺华的沙库巴曲缬沙坦在全球的销售额逐年快速上涨,2018年已达10亿美元,2020年突破20亿美元大关达到24.97亿美元,2021年更涨至35.48亿美元亿美元。沙库巴曲缬沙坦钠片在国内的市场潜力也不容小觑, 2021年在三大终端6大市场合计销售额已超过22亿元。
国内多家研发实力强劲的药企参与了沙库巴曲缬沙坦钠片这个重磅品种的布局,2018年11月上海宣泰海门药业最早进行上市申报,2019年石药欧意、正大天晴、深圳信立泰、以岭万洲国际4家加入战局,之后又有吉林四环制药、成都倍特药业、四川科伦、南京正大天晴、齐鲁制药(海南)等共计16家药企加入首仿之战。谁会顺利拿下首仿,谁又会逆袭,我们等待时间来验证。(详见图5)


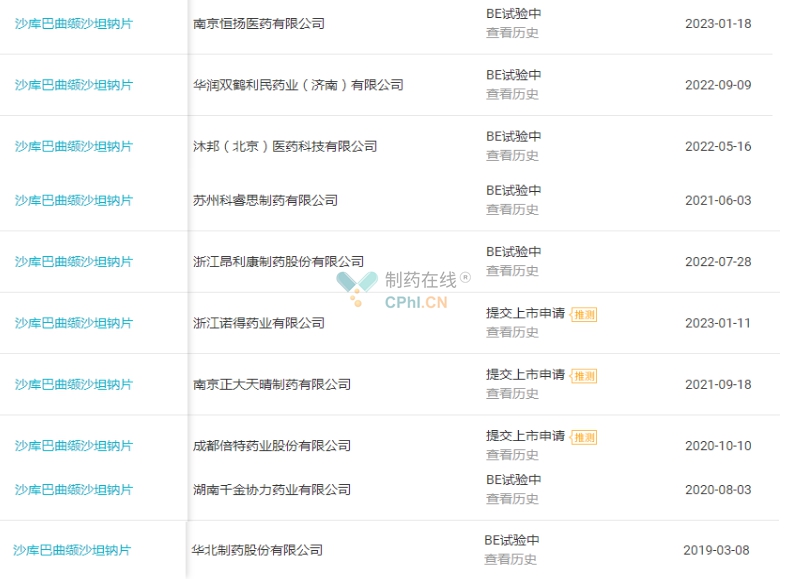
图5 沙库巴曲缬沙坦钠片注册进展(源自丁香园Insight数据库)
06-司来帕格片
司来帕格片是一种口服有效、高选择性和长效的非前列腺素类前列环素受体(IP受体)激动剂,属于罕见病用药。该产品可改善损伤的肺动脉内皮依赖性舒张,并可能抑制人肺平滑肌细胞的增殖、肺血管壁的增厚,用于治疗肺动脉高压(PAH),以延缓疾病进展及降低因 PAH 而住院的风险。与已经上市的用于治疗肺动脉高压的前列环素类药物比较,本品是首 个可以口服的制剂,可改善患者的依从性。
司来帕格片原研公司为强生旗下杨森医药的爱可泰隆(ACTELION),2015年12月21日司来帕格片(商品名:UPTRAVI)获得FDA批准。该产品作为临床急需品种,被我国纳入优先审评程序加快审评审批,2018年12月7日司来帕格片获得国家药监局批准进入国内市场,目前已通过谈判纳入全国医保乙类目录。目前司来帕格片(UPTRAVI)已在全球超过 40 个国家获批。
司来帕格片市场潜力在逐步得以释放,据公开数据显示,司来帕格片2020年全球市场销售达10.93亿美元,中国市场(重点省市公立医院)销售735万元。2021年全球市场销售达12.37亿美元,在中国三大终端6大市场的销售额超过1亿元,同比增长263.1%,
司来帕格片的竞争企业较少,目前只有豪森药业旗下的常州恒邦药业提交了司来帕格片(新4类)仿制药上市申请,暂无其他企业递交司来帕格的仿制上市申请,豪森药业有望斩获该品种国内首仿药。(详见图6)
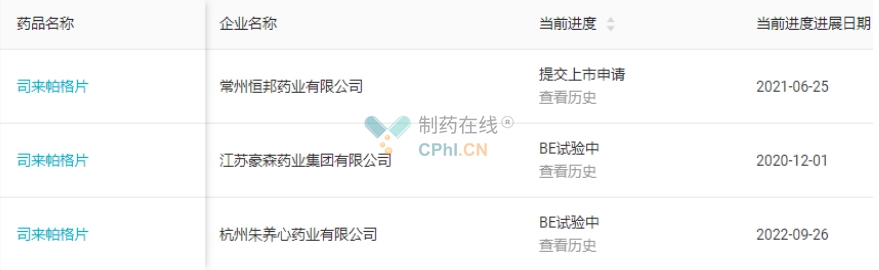
图6 司来帕格片注册进展(源自丁香园Insight数据库)
07-甲磺酸奥希替尼片
奥希替尼是第三代肺癌靶向药物,它是一种不可逆选择性EGFR抑制剂,可同时抑制EGFR敏感突变和EGFR-T790M耐药突变,主要作用于非小细胞肺癌EGFR T790M突变患者,可用于肺癌一代药(吉非替尼、厄洛替尼)或者二代药(阿法替尼)耐药后的治疗。
奥希替尼(商品名:Tagrisso)原研为阿斯利康公司,最早于2015年11月13日在美国获批上市,是用于EGFR T790M突变阳性的局部晚期或转移性NSCLC患者的首 个治疗药物。奥希替尼(Tagrisso)曾获得FDA加速批准、优先审评、突破性治疗药物及孤儿药多重身份,其从临床试验到上市许可仅历时两年半,是阿斯利康史上研发速度最快的新药项目。2016年9月,Tagrisso获国家药监局快速审评通道,历经7个月于2017年3月24日获国家药监局批准上市许可,是中国首 个获批的第三代肺癌靶向药物,在中国上市时间仅比美国获批上市晚16个月。目前该药已在美国、欧盟、中国、日本等40多个国家和地区批准使用。
Tagrisso自上市以来,全球销售额不断攀升,2016年全球销售额突破4.23亿美元,2019年全球销售额达32亿美元,2020年全球销售收入达43.28亿美元,2021奥希替尼的全球销售额年首破 50 亿美元大关,达50.15亿美元,同比增长13%。奥希替尼在国内获批后在全国院内药品销售中一直名列前茅,?2020年该产品在中国公立医疗机构终端及中国城市实体药店终端合计销售额已超45亿元。
奥希替尼国内化合物专利CN103702990将于2032年7月到期,目前仅江苏万邦生化布局该仿制药,其产品于2020年8月完成BE试验,并于2021年5月以仿制4类递交上市申请。(详见图7)

图7 甲磺酸奥希替尼片注册进展(源自丁香园Insight数据库)
08-阿普米司特片
阿普米司特片(曾用名:阿普斯特片)是一种新型的口服小分子磷酸二酯酶-4(PDE-4)小分子抑制剂,对环单磷酸腺苷(cAMP)有特异性,通过剂量依赖性抑制人类滑膜细胞释放肿瘤坏死因子(TNF)-α而发挥作用。阿普米司特片是首 个治疗银屑病/银屑病关节炎的口服新药,用于治疗成年活动性银屑病关节炎(PsA)、用于中度至重度斑块状牛皮癣和用于治疗Behcet病相关的口腔溃疡。
阿普米司特片(商品名:Otezla)最初由百时美施贵宝(BMS)旗下新基公司研发,最早于2014年获得FDA批准上市。安进于2019年8月宣布以高达134亿美元的价格收购获得了阿普米司特全球权益。阿普米司特片用于银屑病关节炎和银屑病的适应症被纳入我国第一批临床急需境外新药名单。2021年2月,安进在中国提交阿普米司特上市申请并被纳入优先审评审批,2021年8月获批上市,用于治疗符合接受光疗或系统治疗指征的中度至重度斑块状银屑病的成人患者。这是中国首 个获批用于斑块状银屑病治疗的口服磷酸二酯酶4(PDE4)抑制剂。
公开数据显示,2018年阿普米司特片(Otezla)全年销售额达到16.08亿美元,2020年该产品全球销售额突破20亿美元大关,达21.95亿美元,
阿普米司特片(Otezla)进入中国市场较晚,但市场竞争较为激烈,最早有石药欧意药业、海南先声药业、齐鲁制药、兆科药业、江苏正大清江制药、杭州朱养心药业、华润双鹤药业/南京海鲸等多家企业以仿制新3类报产,但均未获批。原研产品进入国内后,目前有13家国内企业以新分类仿制4类提交该产品上市申请,其中石药欧意为首家提交上市申请,有望斩获该品种国内首仿药。(详见图8)
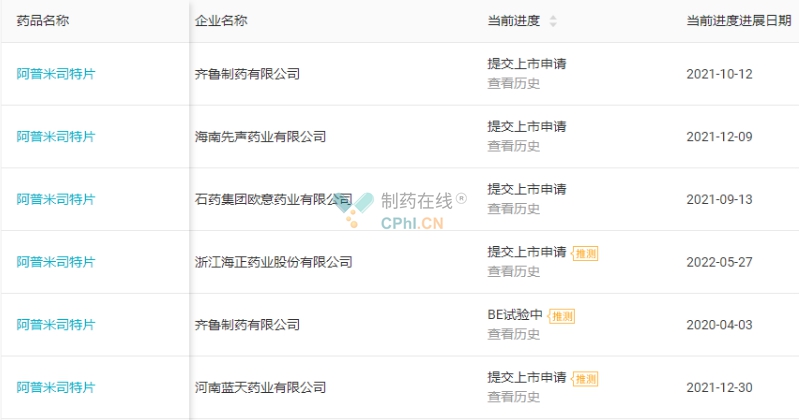


图8 阿普米司特片注册进展(源自丁香园Insight数据库)
09-奥拉帕利片
奥拉帕利(olaparib)是一款口服多腺苷二磷酸核糖聚合酶(PARP)抑制剂,它通过抑制PARP,减少甚至阻止携带有受损BRCA基因的癌细胞进行DNA修复,达到杀死癌细胞死亡的目的,是卵巢癌的首 个单药靶向治疗用药。
奥拉帕利原研由阿斯利康和默沙东-MSD联合开发,商品名为Lynparza。该产品于2014年12月获得FDA批准上市,用于治疗BRCA突变的晚期卵巢癌,是全球首 个获批的PARP抑制剂,用于 BRCA 突变的晚期卵巢癌患者。此后,其适应症得以不断拓展,已被批准用于治疗卵巢癌、胰 腺癌、乳腺癌和前列腺癌,且在卵巢癌治疗上从最初的三线或三线以上疗法扩大到一线维持治疗,从BCRA突变扩大至HRD阳性人群。2018年8月,奥拉帕利片获得国家药监局批准进入国内市场,填补了国内卵巢癌靶向新药治疗领域近30年的空白。
获批以来,奥拉帕利(Lynparza)的销售额始终保持增长态势,根据公开数据显示,奥拉帕利全球销售额在上市后第一年2015年即高达0.94亿美元;2016年销售额为2.18亿美元,增长率高达131.91%;2017年Lynparza全球销售额达2.97亿美元,同比增长率36.24%,奥拉帕利占据了PARP抑制剂64%的市场份额;2018年Lynparza全球销售额为6.47亿美元;2019年销售额已达11.98亿美元,增幅高达85.2%;2020年销售额达到 17.76亿美元;2021年其全球销售额23.48亿美元。在中国市场,该药销售市场潜力十足,根据米内网三大终端六大市场的数据查询,2018年到2021年,奥拉帕利中国市场医院终端+零售终端销售收入分别为1986万元、2.39亿元、9.49亿元、11.63亿元。
2021年10月齐鲁制药(海南)以仿制药4类提交奥拉帕利片上市申请,在国内首家报产,有望成为奥拉帕利国内首仿。之后又有江苏宣泰药业、湖南科伦制药、江苏诚康药业、石药欧意药业、杭州中美华东制药、南京方生和医药、江西山香药业提交了该产品的上市申请。(详见图9)

图9 奥拉帕利片注册进展(源自丁香园Insight数据库)
10-盐酸芬戈莫德胶囊
芬戈莫德是一种神经鞘氨醇1-磷酸受体口服调节剂,与1-磷酸鞘氨醇受体1、3、4和5具有高亲和力结合,是一款针对多发性硬化症的精准靶向治疗肿瘤细胞药物。
芬戈莫德(商品名:Gilenya)原研是诺华,2010年9月21日获FDA批准上市,是全球首 个获批治疗多发性硬化症的口服药物。2011年,芬戈莫德在欧洲和日本获批。芬戈莫德是2018年11月1日CDE发布的第一批临床急需境外新药之一,2019年7月诺华的盐酸芬戈莫德胶囊被NMPA批准用于治疗10岁及以上复发型多发性硬化,商品名为捷灵亚,2020年进入国家医保。
芬戈莫德(Gilenya)是诺华神经科学领域最畅销的产品之一,自上市后销售额持续增长,2012年其全球销售额突破10亿美元大关,之后呈逐年增长态势,2018年达到销售峰值33.41亿美元。之后该药受到赛诺菲、罗氏、拜尔制药等同行竞争和专利到期的影响,销售额有所下滑, 2021年芬戈莫德销售额也达到了近28亿美元。
目前,国内有广东东阳光药业和北京康蒂尼药业两家药企递交了盐酸芬戈莫德胶囊4类仿制药的上市申请。广东东阳光是首家申报,大概率成为盐酸芬戈莫德胶囊国内首仿,且该上市申请以“中美共线生产、已被FDA批准上市”为由被CDE纳入优先审评(2019年12月,广东东阳光芬戈莫德胶囊斩获美国首仿)。(详见图10)
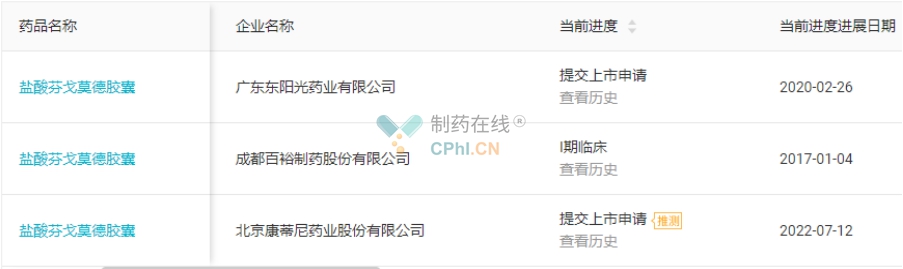
图10 盐酸芬戈莫德胶囊注册进展(源自丁香园Insight数据库)
11-利那洛肽胶囊
利那洛肽是全球首 个鸟苷酸环化酶-C(GC-C)受体激动剂类药物,具有独特的双重作用机制,它与肠道GC-C结合后,使细胞内/外环磷酸鸟苷(cGMP)浓度升高,从而加快胃肠道蠕动,增加排便频率;并降低痛觉神经信号传导,缓解腹痛症状,同时解决排便与缓解腹痛/腹胀两大问题。
利那洛肽胶囊由美国Ironwood公司研发,2012年8月,利那洛肽胶囊由美国FDA批准,用于便秘型肠易激综合征和慢性特发性便秘患者的治疗,商品名为Linzess。截至目前,利那洛肽已经在全球30多个国家获批上市,成为全球便秘型肠易激综合征(IBS-C)治疗领域的领先处方药。阿斯利康与Ironwood公司达成合作,负责该产品在国内的开发、生产及商业化权利,2019年1月15日,利那洛肽胶囊获国家药监局批准在国内上市,用于治疗成人IBS-C,填补了我国成人IBS-C治疗领域的空白。利那洛肽还被纳入2020版药品目录。
自从上市以来,利那洛肽的销售业绩持续增长,市场前景乐观,2020年,利那洛肽的全球销售额超过6亿美元,2021年全球销售额已超过10亿美元。
截至目前,国内仅有三家企业布局该品种,分别为四川国为制药、双鹤药业(海南)以及江苏豪森药业。四川国为制药是首家申报仿制上市的企业,于2021年11月1日提交该品种仿制药上市申请,但最终未被批准。双鹤药业(海南)于2022年10月19日提交了该品种的仿制药上市申请,翰森制药则正在进行BE试验。最终谁将赢得该品种的首仿,我们拭目以待。(详见图11)
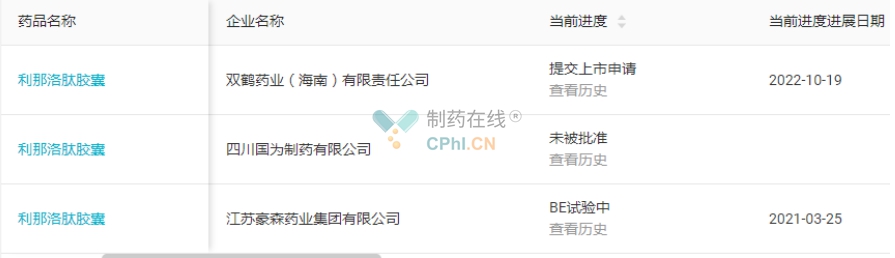
图11 利那洛肽胶囊注册进展(源自丁香园Insight数据库)
12-注射用卡非佐米
卡非佐米(carfilzomib,商品名:Kyprolis)是一种蛋白酶体抑制剂,它属于第二代蛋白酶体抑制剂,用于治疗多发性骨髓瘤患者。后又获批联合来那度胺和地塞米松治疗接受过 1-3 次先前疗法的复发多发性骨髓瘤患者。相比于第一代蛋白酶体抑制剂硼替佐米,卡非佐米具有更强的蛋白酶体抑制活力,更少的脱靶效应。
注射用卡非佐米(Kyprolis)原研是安进,该产品最初由位于美国南旧金山的抗癌药开发公司?Proteolix Inc研发,2009 年由奥尼 克斯(Onyx)收购 Proteolix 获得该品种,2013年8月27日,安进又以104亿美元的价格收购奥尼 克斯(Onyx),获得了卡非佐米的专利权。 2012 年 7 月 20 日Onyx的Kyprolis获 FDA加速批准上市,成为FDA 批准的第二个蛋白酶体抑制剂。2021年7月6日,卡非佐米在国内获国家药监局批准上市。
Kyprolis上市后销售额逐年攀升,2019年销售额突破10亿美元,成为重磅级别的品种,2020年全球销售额10.65亿美元,2021年全球销售收入为11.08亿美元。
2021年9月江苏豪森药业以仿制药3类提交了注射用卡非佐米的上市申请,成为该产品首家报产的企业。另外江苏诚康药业、齐鲁制药(海南)以仿制药4类也已经提交了该产品的上市申请。谁将率先拿下首仿,我们拭目以待。(详见图12)

图12 注射用卡非佐米注册进展(源自丁香园Insight数据库)
下一篇文章将给大家介绍以仿制药3类申报的首仿药。
说明:本文不构成任何价值判断和投资建议。
参考资料:
1-NMPA官网数据库
2-丁香园Insight数据库
3-FDA官网数据库
4-米内网数据库
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030